题目内容
(1)在稀氨水中存在平衡:NH3+H2O?NH3?H2O?NH4++OH-.
a、在稀氨水中,加入适量NaOH晶体时,c(OH-) ,c(NH4+) .(填“增大”“减小”“不变”)
b、氨水是一种弱碱,在水中存在电离平衡:NH3?H2O?NH4++OH-,请写出NH3?H2O电离平衡时的电离平衡常数表达式:Kb= .
(2)写出H2SO4和NaHCO3的电离方程式:H2SO4: 、NaHCO3: .
a、在稀氨水中,加入适量NaOH晶体时,c(OH-)
b、氨水是一种弱碱,在水中存在电离平衡:NH3?H2O?NH4++OH-,请写出NH3?H2O电离平衡时的电离平衡常数表达式:Kb=
(2)写出H2SO4和NaHCO3的电离方程式:H2SO4:
考点:弱电解质在水溶液中的电离平衡,电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:(1)a、在稀氨水中,加入适量NaOH晶体时,溶液中c(OH-)增大,抑制一水合氨电离;
b、Kb=
;
(2)H2SO4电离出氢离子和硫酸根离子,NaHCO3电离出钠离子和碳酸氢根离子.
b、Kb=
c(N
| ||
| c(NH3?H2O) |
(2)H2SO4电离出氢离子和硫酸根离子,NaHCO3电离出钠离子和碳酸氢根离子.
解答:
解:(1)a、在稀氨水中,加入适量NaOH晶体时,溶液中c(OH-)增大,抑制一水合氨电离,则c(NH4+)减小,故答案为:增大;减小;
b、一水合氨是弱电解质,在水溶液里部分电离,电离平衡常数为Kb=
,故答案为:
;
(2)H2SO4电离出氢离子和硫酸根离子,电离方程式为H2SO4═2H++SO42-,NaHCO3电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,
故答案为:H2SO4═2H++SO42-;NaHCO3═Na++HCO3-.
b、一水合氨是弱电解质,在水溶液里部分电离,电离平衡常数为Kb=
c(N
| ||
| c(NH3?H2O) |
c(N
| ||
| c(NH3?H2O) |
(2)H2SO4电离出氢离子和硫酸根离子,电离方程式为H2SO4═2H++SO42-,NaHCO3电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,
故答案为:H2SO4═2H++SO42-;NaHCO3═Na++HCO3-.
点评:本题考查了弱电解质的电离及电离方程式的书写,知道弱电解质的电离平衡常数表达式,会分析弱电解质电离的影响因素,知道电解质电离方程式的书写方式,注意碳酸氢钠、硫酸氢钠电离方程式的区别,题目难度不大.

练习册系列答案
相关题目
聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示.下列有关说法不正确的是( )

| A、M与A均能使酸性高锰酸钾溶液和溴水褪色 |
| B、B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应 |
| C、A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
| D、1molM与热的烧碱溶液反应,可消耗2nmolNaOH |
下列有关实验的描述中错误的是( )
| A、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中溶液全部加热蒸干 |
| B、蒸馏操作时,应将温度计水银球置于蒸馏烧瓶的支管口附近 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、使用容量瓶和分液漏斗前,要先检查是否漏水后使用 |
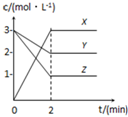 如图表示800℃时,X、Y、Z三种气体物质的浓度随时间变化的情况.试回答:
如图表示800℃时,X、Y、Z三种气体物质的浓度随时间变化的情况.试回答: