题目内容
6.用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下: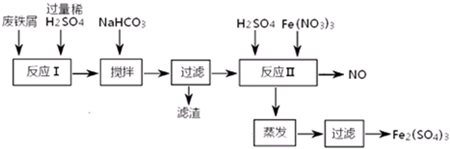
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
②反应Ⅱ中反应的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
③实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
分析 由流程可知,Fe、Al和稀硫酸反应生成FeSO4、Al2(SO4)3和氢气,向混合溶液中加入NaHCO3,调节溶液的pH,根据沉淀物与pH的关系知,要是铝离子产生沉淀,则pH应该在4.4-7.5之间,然后过滤得到滤液,向滤液中加入稀硫酸、硝酸铁,酸性条件下,亚铁离子被氧化生成铁离子,同时生成NO,然后采用蒸发浓缩、冷却结晶、过滤得到Fe2(SO4)3,以此来解答.
解答 解:由流程可知,Fe、Al和稀硫酸反应生成FeSO4、Al2(SO4)3和氢气,向混合溶液中加入NaHCO3,调节溶液的pH,根据沉淀物与pH的关系知,要是铝离子产生沉淀,则pH应该在4.4-7.5之间,然后过滤得到滤液,向滤液中加入稀硫酸、硝酸铁,酸性条件下,亚铁离子被氧化生成铁离子,同时生成NO,然后采用蒸发浓缩、冷却结晶、过滤得到Fe2(SO4)3,
①加NaHCO3时,混合液pH值应控制在Al(OH)3完全沉淀、Fe(OH)2不产生沉淀,根据沉淀物与pH的关系知,要是铝离子产生沉淀,则pH应该在4.4-7.5之间,
故答案为:4.4~7.5
②酸性条件下,硝酸根离子和亚铁离子发生氧化还原反应,离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
③反应Ⅱ中需要强氧化性的酸将二价铁离子氧化,一氧化氮有毒,但一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将O2和反应Ⅱ产生的NO,按3:4配比混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染,
故答案为:节约Fe(NO3)3、防止NO污染;3:4.
点评 本题考查物质的制备实验,为高频考点,把握流程中的反应及混合物分离为解答本题的关键,注意酸性条件下硝酸根离子具有强氧化性,侧重分析与实验能力的考查,题目难度中等.

| A. | 转移电子4.8NA个 | B. | 生成气体的体积42.56L(标准状况) | ||
| C. | 还原剂比氧化剂多0.2mol | D. | 被还原的氮原子是11.2g |
| A. | 常温常压下,0.05NA个CO2分子所占的体积是1.12L | |
| B. | 1mol 氧气所含有的原子数为NA | |
| C. | 常温常压下,32g O2和34g H2S气体分子个数比为1:1 | |
| D. | 11.2L NH3中所含的质子数为5NA |
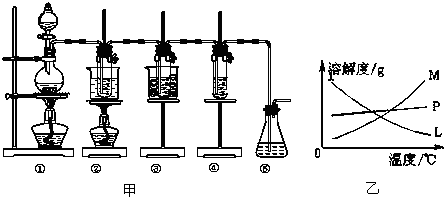
图甲中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有C(填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL 12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因有:①浓盐酸挥发变稀,②反应一段时间后,浓盐酸消耗变稀,无法被二氧化锰氧化.
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①制取温度不同,制取氯酸钾需要较高温度,制取次氯酸钠需要较低温度;
②制取时,碱的浓度也不同,制取氯酸钾需要浓度较大的碱,制取次氯酸钠需要浓度较小的碱.
反应完毕经冷却后,②的试管中有大量晶体析出.图乙中符合该晶体溶解度曲线的是M(填写编号字母);
从②的试管中分离出该晶体的方法是过滤(填写实验操作名称).
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成次氯酸具有漂白性 |
| 然后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
已知:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质.

(1)配平制备ClO2的化学方程式:2KClO3+1H2C2O4--2KHCO3+2ClO2↑
(2)A装置中还缺少的一样仪器名称是温度计,B装置的作用是将ClO2冷凝收集.
(3)C装置吸收尾气后,溶液中含有NaOH、NaClO2、NaClO3等溶质,小组成员认为C中还可能含有Na2CO3,试分析可能的原因是过量的草酸与KHCO3反应,逸出的CO2与NaOH溶液反应生成Na2CO3或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3.
(4)小组成员查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:只存在CaC2O4.
②基于假设2,设计实验方案,进行实验.请在答题卷上写出实验步骤以及预期现象和结论.限选实验试剂:1mol•L-1 H2SO4、0.1mol•L-1 HCl、0.01mol•L-1 KMnO4、澄清石灰水.
| 实验步骤 | 预期现象和结论 |
步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl . | 沉淀全部溶解,有气泡产生,说明沉淀中有CaCO3 |
步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4 . | 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,假设2成立 |
| A. | 1mol | B. | 3mol | C. | 4mol | D. | 6mol |
 已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )| A. | 铅蓄电池放电时,电路中每转移2mol电子,生成1mol硫酸铅 | |
| B. | 如图,铁铆钉发生吸氧腐蚀,在铁钉附近滴加K3[Fe(CN)6]溶液,可观察铁钉附近有蓝色沉淀产生 | |
| C. | 铅蓄电池充电时,阳极电极反应为 PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| D. | 铅蓄电池放电时,内电路硫酸根离子向铅极移动,正极附近溶液的pH增大 |
