题目内容
16. 已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )| A. | 铅蓄电池放电时,电路中每转移2mol电子,生成1mol硫酸铅 | |
| B. | 如图,铁铆钉发生吸氧腐蚀,在铁钉附近滴加K3[Fe(CN)6]溶液,可观察铁钉附近有蓝色沉淀产生 | |
| C. | 铅蓄电池充电时,阳极电极反应为 PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| D. | 铅蓄电池放电时,内电路硫酸根离子向铅极移动,正极附近溶液的pH增大 |
分析 A、反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O中,转移电子2mol,生成硫酸铅2mol;
B、铁铆钉发生吸氧腐蚀,铁作负极,该极上生成Fe2+;
C、电解池的阳极发生失电子的氧化反应,电极反应为PbSO4+2H2O-2e-=PbO2+4H++SO42-;
D、放电是原电池,溶液中H+向正极移动,硫酸根离子向负极移动.
解答 解:A、放电是原电池,依据电池反应Pb+PbO2+2H2SO4?2PbSO4+2H2O,转移电子2mol生成2mol硫酸铅,故A错误;
B、铁铆钉发生吸氧腐蚀,铁作负极,在铁附近生成Fe2+,Fe2+与K3[Fe(CN)6]溶液反应生成蓝色沉淀,故B正确;
C、阳极发生失电子的氧化反应,电极反应为PbSO4+2H2O-2e-=PbO2+4H++SO42-,故C正确;
D、放电是原电池,Pb是负极,硫酸根离子向负极(Pb)移动,溶液中H+向正极移动,所以正极附近溶液的pH增大,故D正确;
故选A.
点评 本题考查了原电池和电解池原理的应用、电极名称、电极反应的分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
6.用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:
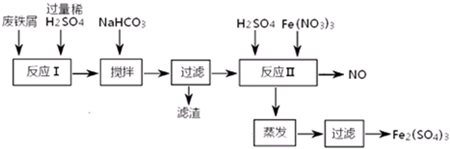
①加NaHCO3时,混合液pH值应控制在4.4~7.5.
②反应Ⅱ中反应的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
③实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
②反应Ⅱ中反应的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
③实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
4.化学与社会、环境密切相关,下列有关说法正确的是( )
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 氯气和氢氧化钠溶液或石灰乳反应得到的含氯化合物都具有漂白性 | |
| C. | 光导纤维遇强酸会“断路” | |
| D. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
8.在同温同压下,使4体积的H2和O2混合气体充分反应,生成液态水,最后剩余1体积气体,则混合体中的H2和O2的体积比可能是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |




