题目内容
18.硫酸是重要的化工生产原料,工业上常用硫铁矿焙烧生成SO2,SO2氧化到SO3,再用98.3%左右的浓硫酸吸收SO3得到“发烟”硫酸(H2SO4•SO3).最后用制得的“发烟”硫酸配制各种不同浓度的硫酸用于工业生产.完成下列计算:
(1)1kg 98%的浓硫酸吸收SO3后,可生产1.978kg“发烟”硫酸.
(2)“发烟”硫酸(H2SO4•SO3)溶于水,其中SO3都转化为硫酸.若将890g“发烟”硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为2.5mol/L.
(3)硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2
4FeS2+11O2→2Fe2O3+8SO2
①1吨含FeS280%的硫铁矿,理论上可生产多少吨98%的浓硫酸?
②若24mol FeS2完全反应耗用氧气1467.2L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比.
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法.
硫化氢与水蒸气的混合气体在空气中完全燃烧,再经过催化氧化冷却制得了98%的浓硫酸(整个过程中SO2损失2%,不补充水不损失水)求硫化氢在混合气中的体积分数.
分析 (1)计算浓硫酸中H2SO4、H2O的质量,根据H2O的质量计算吸收SO3生成H2SO4质量,进而计算H2SO4总质量,再根据关系式H2SO4~H2SO4•SO3计算发烟硫酸质量;
(2)根据n=$\frac{m}{M}$计算H2SO4•SO3的物质的量,根据硫元素守恒计算n(H2SO4),再根据c=$\frac{n}{V}$计算;
(3)①根据硫元素守恒可得关系式:FeS2~2SO2~2SO3~2H2SO4,据此计算;
②根据硫元素守恒计算二氧化硫物质的量,设Fe3O4、Fe2O3物质的量分别为xmol、ymol,根据Fe原子守恒、O原子守恒列方程计算解答;
(4)98%的浓硫酸化学式可以表示为H2SO4.$\frac{1}{9}$H2O,假设硫化氢为amol,整个过程中SO2损失2%,则S元素利用率为98%,再根据S元素守恒表示出H2SO4.$\frac{1}{9}$H2O的物质的量,再根据H原子守恒计算硫化氢与水蒸气总物质的量,进而计算硫化氢的体积分数.
解答 解:(1)1kg 98%的浓硫酸中H2SO4的质量为1kg×98%=0.98g,故H2O的质量为1kg-0.98g=0.02kg,由H2O+SO3=H2SO4,可知生成H2SO4的质量为0.02kg×$\frac{98}{18}$,故H2SO4总质量=0.98g+0.02kg×$\frac{98}{18}$=$\frac{9.8}{9}$kg,根据关系式H2SO4~H2SO4•SO3,可知得到发烟硫酸质量为:$\frac{9.8}{9}$kg×$\frac{98+80}{98}$=1.978kg,
故答案为:1.978;
(2)H2SO4•SO3的物质的量为$\frac{890g}{178g/mol}$=5mol,根据硫元素守恒n(H2SO4)=2n(H2SO4•SO3)=10mol,该硫酸的物质的量浓度为$\frac{10mol}{4L}$=2.5mol/L,
故答案为:2.5;
(3)①设理论上可生产x吨98%的浓硫酸,则:
FeS2~2SO2~2SO3~2H2SO4
120 2×98
1吨×80% x吨×98%
所以120:2×98=1吨×80%:x吨×98%,解得x=1.33
答:理论上可生产1.33吨98%的浓硫酸;
②根据硫元素守恒,n(SO2)=2n(FeS2)=48mol,消耗氧气物质的量为65.5mol,设Fe3O4、Fe2O3物质的量分别为xmol、ymol,根据Fe原子守恒、O原子守恒,则:$\left\{\begin{array}{l}{3x+2y=24}\\{4x+3y=65.5×2-48×2}\end{array}\right.$,解得:$\left\{\begin{array}{l}{x=2}\\{y=9}\end{array}\right.$,故Fe3O4、Fe2O3物质的量之比为2:9,
答:反应产物中Fe3O4与Fe2O3物质的量之比为2:9;
(4)98%的浓硫酸中H2SO4、H2O的物质的量之比为$\frac{98g}{98g/mol}$:$\frac{2g}{18g/mol}$=1:$\frac{1}{9}$,98%的浓硫酸化学式可以表示为H2SO4.$\frac{1}{9}$H2O,假设硫化氢为amol,整个过程中SO2损失2%,则S元素利用率为98%,根据S元素守恒,H2SO4.$\frac{1}{9}$H2O的物质的量amol×98%,根据H原子守恒,硫化氢与水蒸气总物质的量为amol×98%×(1+$\frac{1}{9}$)=$\frac{9.8a}{9}$mol,故硫化氢的体积分数为$\frac{amol}{\frac{9.8a}{9}mol}$=0.918,
答:硫化氢在混合气中的体积分数为0.918.
点评 本题考查化学计算,涉及混合物的有关计算、根据方程式的有关计算,过程复杂、计算量很大,为易错题目,难度较大.

| A. | 1:6:9 | B. | 1:2:3 | C. | 1:3:3 | D. | 1:3:6 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
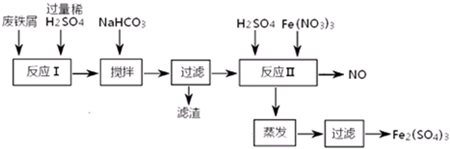
②反应Ⅱ中反应的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
③实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |

 .
.
