题目内容
4.用NA表示表示阿伏伽德罗常数的值,下列说法中正确的是( )| A. | 常温常压下,0.05NA个CO2分子所占的体积是1.12L | |
| B. | 1mol 氧气所含有的原子数为NA | |
| C. | 常温常压下,32g O2和34g H2S气体分子个数比为1:1 | |
| D. | 11.2L NH3中所含的质子数为5NA |
分析 A.常温常压,Vm≠22.4L/mol;
B.1个氧气分子含有2个氧原子;
C.质量转化为物质的量,分子数目之比等于物质的量之比;
D.气体状况未知,Vm大小未知.
解答 解:A.常温常压,Vm≠22.4L/mol,Vm未知无法计算气体的体积,故A错误;
B.1mol 氧气含有2mol氧原子,所含有的原子数为2NA,故B错误;
C.32gO2的物质的量为$\frac{32g}{32g/mol}$=1mol,34g H2S的物质的量为$\frac{34g}{34g/mol}$=1mol,分子数目之比等于物质的量之比为1:1,故C正确;
D.气体状况未知,Vm大小未知,无法计算氨气的物质的量,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件应用,质量换算物质的量计算微粒数的应用,掌握相关公式即可解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.现有6瓶失去标签的液体,已知它们可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖中的一种.现通过如下实验来确定各试剂瓶中所装液体的名称:
(1)A的俗名为酒精,B中所含官能团的名称为羧基. D的结构简式为CH3COOCH2CH3.
(2)在D中加入NaOH溶液并加热的化学方程式为CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH.
(3)C的二氯代物有三种同分异构体;
(4)若将1mol乙醇(其中的羟基氧用18O标记)在浓硫酸存在下并加热与足量乙酸充分反应.则生成的乙酸乙酯的质量大于88g(填:大于,小于或等于)
(5)已知乙醛发生银镜反的方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{加热}{→}$CH3COONH4+H2O+2Ag↓+3NH3,试写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+H2O+3NH3.
| 实验步骤和方法 | 实验现象 |
| ①把6瓶液体分别依次标号A、B、C、D、E、F,然后闻气味 | 只有F没有气味 |
| ②各取少量于试管中,加水稀释 | 只有C、D、E不溶解而浮在水面上 |
| ③分别取少量6种液体于试管中,加新制Cu(OH)并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
(2)在D中加入NaOH溶液并加热的化学方程式为CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH.
(3)C的二氯代物有三种同分异构体;
(4)若将1mol乙醇(其中的羟基氧用18O标记)在浓硫酸存在下并加热与足量乙酸充分反应.则生成的乙酸乙酯的质量大于88g(填:大于,小于或等于)
(5)已知乙醛发生银镜反的方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{加热}{→}$CH3COONH4+H2O+2Ag↓+3NH3,试写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+H2O+3NH3.
12.下列叙述中正确的是( )
| A. | 实现H2→H+H的变化,要放出能量 | |
| B. | 液态水变成气态水要吸收能量 | |
| C. | 金刚石在一定条件变成石墨要吸收能量 | |
| D. | CaO和水反应过程中焓变大于0 |
6.用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:
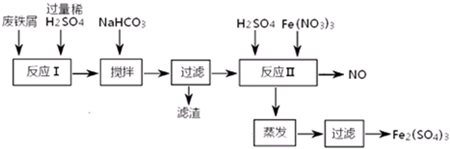
①加NaHCO3时,混合液pH值应控制在4.4~7.5.
②反应Ⅱ中反应的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
③实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
②反应Ⅱ中反应的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
③实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
4.化学与社会、环境密切相关,下列有关说法正确的是( )
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 氯气和氢氧化钠溶液或石灰乳反应得到的含氯化合物都具有漂白性 | |
| C. | 光导纤维遇强酸会“断路” | |
| D. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
 .
.