题目内容
11.某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)已知:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质.

(1)配平制备ClO2的化学方程式:2KClO3+1H2C2O4--2KHCO3+2ClO2↑
(2)A装置中还缺少的一样仪器名称是温度计,B装置的作用是将ClO2冷凝收集.
(3)C装置吸收尾气后,溶液中含有NaOH、NaClO2、NaClO3等溶质,小组成员认为C中还可能含有Na2CO3,试分析可能的原因是过量的草酸与KHCO3反应,逸出的CO2与NaOH溶液反应生成Na2CO3或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3.
(4)小组成员查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:只存在CaC2O4.
②基于假设2,设计实验方案,进行实验.请在答题卷上写出实验步骤以及预期现象和结论.限选实验试剂:1mol•L-1 H2SO4、0.1mol•L-1 HCl、0.01mol•L-1 KMnO4、澄清石灰水.
| 实验步骤 | 预期现象和结论 |
步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl . | 沉淀全部溶解,有气泡产生,说明沉淀中有CaCO3 |
步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4 . | 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,假设2成立 |
分析 (1)根据质量守恒和得失电子守恒配平方程式;
(2)反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2分析,ClO2沸点较低,易液化;
(3)草酸可与生成物碳酸氢钾反应生成二氧化碳,或KClO3氧化草酸生成二氧化碳气体;
(4)①沉淀可能为CaCO3或CaC2O4或二者都有;
②利用盐酸和碳酸钙反应生成二氧化碳气体能使澄清石灰水变浑浊验证碳酸钙的存在,加入的酸溶解生成的草酸和高锰酸钾溶液反应使溶液褪色来设计实验进行验证草酸钙的存在.
解答 解:(1)由质量守恒和得失电子守恒可配平,方程式为2KClO3+H2C2O4=2KHCO3+2ClO2↑,故答案为:2;1;2;2;
(2)反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2,需要温度计控制温度,A装置中还缺少的一样仪器名称是为温度计,ClO2的沸点较低,易液化,B可起到冷凝收集的作用,
故答案为:将ClO2冷凝收集;
(3)反应后生成KHCO3,过量的草酸与KHCO3反应:HOOC-COOH+KHCO3=CO2↑+H2O+HOOC-COOK,逸出的CO2与NaOH溶液反应生成Na2CO3,CO2+2NaOH=Na2CO3+H2O,
也可能为因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3,
故答案为:过量的草酸与KHCO3反应:HOOC-COOH+KHCO3=CO2↑+H2O+HOOC-COOK,逸出的CO2与NaOH溶液反应生成Na2CO3,CO2+2NaOH=Na2CO3+H2O;或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3;
(4)①沉淀可能为CaCO3或CaC2O4或二者都有,故答案为:只存在CaC2O4;
②进行实验先检验碳酸钙的存在,再利用加入的酸溶解生成的草酸和高锰酸钾溶液反应使溶液褪色来设计实验进行验证,取少量沉淀于试管中,加入足量1 mol•L-1 HCl,将产生的气体通入澄清石灰水中,澄清石灰水变浑浊,说明菠菜中含有碳酸盐,向步骤1得到的溶液中滴加几滴0.01 mol•L-1 KMnO4溶液紫红色褪去,说明菠菜中含有草酸盐,
故答案为:
| 实验步骤 | 预期现象和结论 |
| 足量0.1 mol•L-1 HCl | 沉淀全部溶解,有气泡产生,说明沉淀中有CaCO3 |
| 往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4 | 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,假设2成立 |
点评 本题考查了物质性质的实验设计和实验分析判断,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,掌握实验基础和物质性质是解题关键,题目难度中等.

| A. | 阿伏伽德罗常数是指1mol物质中所含有的原子数 | |
| B. | 微粒的数目与物质的量成正比 | |
| C. | 国际上规定0.012kg12C中所含碳原子数为阿伏伽德罗常数 | |
| D. | 1mol O2中的分子数为NA,而原子数为2NA |
| A. | 实现H2→H+H的变化,要放出能量 | |
| B. | 液态水变成气态水要吸收能量 | |
| C. | 金刚石在一定条件变成石墨要吸收能量 | |
| D. | CaO和水反应过程中焓变大于0 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
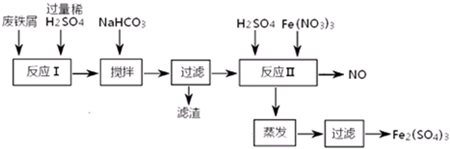
②反应Ⅱ中反应的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
③实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
 .
.



