题目内容
3.(1)1molO2与1molO3分子数之比为1:1.(2)H2O的摩尔质量为18g/mol.
(3)标准状况下,0.1mol的氧气的体积为2.24L.
(4)2L0.5mol/LCaCl2溶液中Ca2+浓度0.5mol/L.
分析 (1)分子数目之比等于物质的量之比;
(2)摩尔质量以g/mol为单位,数值上等于其相对分子质量;
(3)根据V=nVm计算;
(4)电解质溶液中离子浓度=电解质浓度×化学式中离子数目,与溶液体积无关.
解答 解:(1)1molO2与1molO3分子数之比为1:1,故答案为:1:1;
(2)H2O的摩尔质量为18g/mol,故答案为:18;
(3)标准状况下,0.1mol的氧气的体积为0.1mol×22.4L/mol=2.24L,故答案为:2.24;
(4)2L0.5mol/LCaCl2溶液中Ca2+浓度1×0.5mol/L=0.5mol/L,故答案为:0.5.
点评 本题考查物质的量有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
13.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
已知气体分压(P分)=气体总压(P总)×体积分数,下列说法不正确的是( )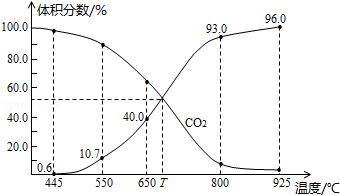
已知气体分压(P分)=气体总压(P总)×体积分数,下列说法不正确的是( )

| A. | 550℃时,若充入惰性气体,v正,v逆均减小 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=23.04P总 |
11.向含a mol氯化铝的溶液中加入含b mol氢氧化钾溶液,生成沉淀物质的量可能是( )
①a mol ②b mol ③a/3mol ④b/3mol ⑤0mol ⑥(4a-b) mol.
①a mol ②b mol ③a/3mol ④b/3mol ⑤0mol ⑥(4a-b) mol.
| A. | ①②③ | B. | ①②④⑤ | C. | ①②④⑤⑥ | D. | ①③④⑤⑥ |
18.下列有关实验的说法正确的是( )
| A. | 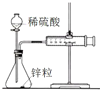 图中测定锌粒与1 mol/L稀硫酸反应速率,只需测定量筒中收集氢气的体积 | |
| B. |  装置中进行50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液测定中和热,使温度计温度升高的热量就是中和反应生成1 mol水的热量 | |
| C. |  酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁以减小实验误差 | |
| D. |  滴定管中读数为26.50mL |
8.已知,E(N≡N )=945kJ•mol-1,EH-H=436kJ•mol-1,EN-H=391kJ•mol-1.那么1mol N2与3mol H2合成氨时的能量变化为( )
| A. | 吸收208 kJ的热量 | B. | 放出208 kJ的热量 | ||
| C. | 吸收93 kJ的热量 | D. | 放出93 kJ的热量 |
15.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24L丙烷中含有的共用电子对数为NA | |
| B. | 25℃时,pH=1的盐酸和醋酸溶液所含H+数均为0.1 NA | |
| C. | 利用双氧水制氧气,每生成1molO2转移电子数为4 NA | |
| D. | 100mL 12mo1•L-1的浓盐酸与足量MnO2加热反应,生成C12分子数为0.3 NA |
12.2.3g纯钠在干燥空气中被氧化后得到3.1g固体,由此可判断其产物是( )
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O和Na2O2 | D. | 无法确定 |
13.已知拆开1mol氢气中的化学键需要436.4kJ能量,拆开1mol氧气中的化学键需要消耗498kJ能量,形成水分子中的1molH-O键能够释放462.8kJ能量,则下列热化学方程式中正确的是( )
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-480.4kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-240.2kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(g)△H=+480.4kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-480.4kJ/mol |
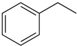 (g)→
(g)→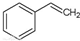 (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; +CO(g)+H2O(g) △H=+158.8 kJ/mol
+CO(g)+H2O(g) △H=+158.8 kJ/mol