题目内容
11.向含a mol氯化铝的溶液中加入含b mol氢氧化钾溶液,生成沉淀物质的量可能是( )①a mol ②b mol ③a/3mol ④b/3mol ⑤0mol ⑥(4a-b) mol.
| A. | ①②③ | B. | ①②④⑤ | C. | ①②④⑤⑥ | D. | ①③④⑤⑥ |
分析 会发生反应:AlCl3+3KOH═Al(OH)3↓+3KCl、Al(OH)3+KOH═KAlO2+2H2O,讨论a、b相对大小关系,存在的情况有:AlCl3过量、AlCl3和KOH恰好完全反应、KOH过量,结合方程式计算解答.
解答 解:发生的反应:AlCl3+3KOH═Al(OH)3↓+3KCl、Al(OH)3+KOH═KAlO2+2H2O.
(1)若a:b=1:3时,发生AlCl3+3KOH═Al(OH)3↓+3KCl,根据方程式知,生成n[Al(OH)3]=n(AlCl3)=$\frac{1}{3}$n(KOH),即为amol、$\frac{b}{3}$mol;
若a:b>1:3时,发生AlCl3+3KOH═Al(OH)3↓+3KCl,根据方程式知,生成n[Al(OH)3]=n(AlCl3)=amol,故①④正确;
(2)若3:1<b:a<4:1时,发生反应:AlCl3+3KOH═Al(OH)3↓+3KCl、Al(OH)3+KOH═KAlO2+2H2O,生成沉淀的物质的量等于amol-(b-3a)mol=(4a-b)mol,故⑥正确,
当b=3a+$\frac{2}{3}$a,发生AlCl3+3KOH═Al(OH)3↓+3KCl、Al(OH)3+KOH═KAlO2+2H2O,生成沉淀的物质的量等于amol-$\frac{2}{3}$amol=$\frac{a}{3}$mol,故③正确;
(3)若b≥4a,发生AlCl3+4KOH═KAlO2+2H2O+3KCl,则生成沉淀的物质的量为0,故⑤正确;
故选D.
点评 本题考查化学方程式有关计算,关键是利用极限和区间的方法来分析生成沉淀的几种可能性,同时考查学生思维缜密性,题目难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
1.下列有关物质性质的比较,错误的是( )
| A. | 溶解度(25℃):小苏打<苏打 | B. | 沸点:H2Se>H2S>H2O | ||
| C. | 密度:溴乙烷>水 | D. | 碳碳键键长:乙烯<苯 |
2.己烯雌酚是一种激素类药物,结构如图所示,下列有关叙述中正确的是( )

| A. | 该有机物属于芳香烃 | |
| B. | 该物质不能使酸性高锰酸钾溶液褪色 | |
| C. | 该分子对称性好,所以没有顺反异构 | |
| D. | 该有机物分子中,最多可能有18个碳原子共平面 |
19.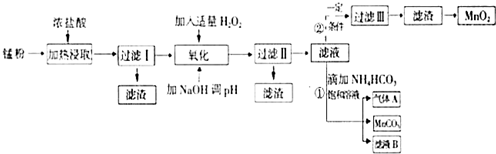 面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
根据以上信息回答问题:
(1)过滤Ⅰ得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节PH的范围为8.5<PH<8.8,其作用是除去溶液中的Fe3+、Zn2+.
(3)过滤Ⅱ后滤液中阳离子主要是Mn2+.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2 中加入过量酸化的0.50mol/L H2C2O4,50.00mL,MnO2 完全溶解,并产生A气体,写出该反应的离子方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O.
然后用0.10mol/L KMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是24.1%(保留2位有效数字).
 面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:
面对日益严重的环境问题,“变废为宝”是化学发展的一个重要方向.例如用废旧酸性锌锰干电池经破碎后的锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]制取MnO2及高性能磁性材料碳酸锰(MnCO3),工艺流程如图所示:| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时PH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时PH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤Ⅰ得到的滤渣主要成分是碳黑.
(2)流程中氧化后加入NaOH溶液调节PH的范围为8.5<PH<8.8,其作用是除去溶液中的Fe3+、Zn2+.
(3)过滤Ⅱ后滤液中阳离子主要是Mn2+.
(4)过程①中,滤液B含NH4Cl,则生成的气体A是CO2.
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH.
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量.
首先向制取的MnO2 中加入过量酸化的0.50mol/L H2C2O4,50.00mL,MnO2 完全溶解,并产生A气体,写出该反应的离子方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O.
然后用0.10mol/L KMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),滴定终点时消耗KMnO4溶液30.00mL,求锰粉中的锰元素质量分数是24.1%(保留2位有效数字).
6.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4 L的H2O中含有的分子数为NA | |
| B. | 7.8g Na2S固体和7.8 g Na2O2固体中含有的阴离子数目均为0.1NA | |
| C. | 46克 Na与足量氧气反应转移的电子数为2NA | |
| D. | 1 L 1mol•L-1 Na2CO3溶液中含有的钠离子数为NA |
20.下列关于安全事故的处理方法中,正确的是 ( )
| A. | 金属钠着火时,立即用水喷洒 | |
| B. | 大量氯气泄漏时,迅速离开现场,并尽量往高处去 | |
| C. | 不慎洒出的酒精在桌上着火时,立即用大量水扑灭 | |
| D. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 |
