题目内容
18.只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )| A. | Ba(OH)2 | B. | H2SO4 | C. | NaOH | D. | Fe(OH)3胶体 |
分析 阳离子各不相同,可利用与碱反应的不同现象来解答.
解答 解:A.Ba(OH)2不能鉴别Na2SO4、MgCl2、Al2(SO4)3,故A不选;
B.均不与硫酸反应,不能鉴别,故B不选;
C.Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液分别与NaOH溶液反应的现象:无现象、白色沉淀、白色沉淀迅速变为灰绿色最后为红褐色、白色沉淀后消失、刺激性气体,现象不同,可鉴别,故C选;
D.Fe(OH)3胶体不能鉴别五种溶液,故D不选;
故选C.
点评 本题考查物质的鉴别和检验,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握物质的性质、发生的反应及元素化合物知识为解答该题的关键,难度不大.

练习册系列答案
相关题目
8.下列各组离子中,在酸性溶液中能够大量共存,且通入Cl2后没有明显变化的是( )
| A. | K+、Na+、Cl-、I- | B. | Ca2+、Mg2+、HCO3-、NO3- | ||
| C. | K+、Cu2+、SO42-、Cl- | D. | Ag+、Ba2+、NO3-、CO32- |
9.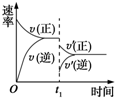 在密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( )
在密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( )
 在密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( )
在密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( )| A. | 催化剂失效 | B. | 减小生成物的浓度 | ||
| C. | 降低体系温度 | D. | 增大容器的体积 |
6.下列反应的离子方程式正确的是( )
| A. | .碳酸氢钙溶液中加入氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| B. | 用胃舒平治疗胃酸过多:Al(OH)3+3H+═Al3++3H2O | |
| C. | Na与H2O反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
3.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为22.4L | |
| B. | 常温常压下,28g N2中含有的原子数为NA | |
| C. | 标准状况下22.4L Cl2与足量的水充分反应,转移的电子数为NA | |
| D. | 标准状况下,11.2LH2O含有的分子数为0.5NA |
10.Na、Mg、Al的有关性质的叙述正确的是( )
| A. | 金属性:Na>Mg>Al | B. | 第一电离能:Na<Mg<Al | ||
| C. | 电负性:Na>Mg>Al | D. | 碱性:NaOH<Mg(OH)2<Al(OH)3 |

 .
. .
. .
. .
. .
.