题目内容
8.下列各组离子中,在酸性溶液中能够大量共存,且通入Cl2后没有明显变化的是( )| A. | K+、Na+、Cl-、I- | B. | Ca2+、Mg2+、HCO3-、NO3- | ||
| C. | K+、Cu2+、SO42-、Cl- | D. | Ag+、Ba2+、NO3-、CO32- |
分析 酸溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合通入Cl2后没有明显变化来解答.
解答 解:A.通入Cl2后与I-反应,溶液颜色加深,故A不选;
B.酸溶液中不能大量存在HCO3-,故B不选;
C.酸溶液中该组离子之间不反应,可大量共存,且通入Cl2后没有明显变化,故C选;
D.Ag+、Ba2+分别与CO32-结合生成沉淀,不能共存,故D不选;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
6.下列物质中含有氯分子的是( )
| A. | 注射用KCl溶液 | B. | 氯化钠 | C. | 液态氯化氢 | D. | 液氯 |
7.分子式为C5H10的化合物中,属于链烃结构的共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
4.下列离子方程式正确的是( )
| A. | 向NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 向饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O=2NaHCO3↓ | |
| C. | 向Ca(HCO3)2溶液中加入足量Ca(OH)2溶液:Ca2++HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| D. | 硫酸溶液于氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
3.某无色溶液可能含有Na+、Ba2+、Cl-、Br-、SO32-、SO42-中的一种或几种,对该溶液进行下列实验,实验操作和现象如表所示:
下列结论正确的是( )
| 步骤 | 操作 | 现象 |
| (1) | 用pH试纸检验 | 溶液的pH大于7 |
| (2) | 另取少量溶液滴加过量氨水,再通入CCl4振荡,静置 | 上层无色,下层呈橙红色 |
| (3) | 取(2)的上层溶液,加入过量Ba(SO4)2溶液和稀硝酸,过滤 | 有白色沉淀产生 |
| (4) | 向(3)的滤液中加入过量AgNO3溶液和稀硝酸 | 有白色沉淀产生 |
| A. | 肯定含有的离子是Na+、Br-、SO32- | B. | 肯定没有的离子是Ba2+、SO42- | ||
| C. | 不能确定的离子是Na+ | D. | 不能确定的离子是Cl-、SO32- |
13.PH=1的无色透明溶液中,能大量共存的离子组是( )
| A. | Al3+、Ag+、HCO3-、Cl- | B. | Mg2+、NH4+、NO3-、Cl- | ||
| C. | Ba2+、K+、Fe3+、Cl- | D. | K+、Na+、OH-、CO32- |
20.根据图所示的N2 (g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是( )
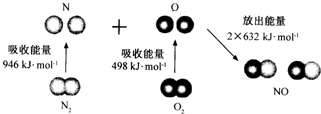

| A. | N2 (g)和O2(g)反应生成NO(g)是放热反应 | |
| B. | 2 molO原子结合生成O2(g)时需要吸收498kJ能量 | |
| C. | N2(g)+O2(g)=2NO(g)的反应热△H=+1444kJ•mol-1 | |
| D. | 1molNO(g)分子中的化学键断裂时需要吸收632kJ能量 |
18.只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
| A. | Ba(OH)2 | B. | H2SO4 | C. | NaOH | D. | Fe(OH)3胶体 |
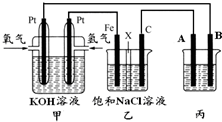 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和电镀的原理,其中乙装置中X为阳离子交换膜.
某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和电镀的原理,其中乙装置中X为阳离子交换膜.