题目内容
7.下列说法正确的是( )| A. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| B. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| C. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 | |
| D. | 在3S+6KOH=2K2S+K2SO3+3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是1:2 |
分析 A.分散系的分离依据为分散质粒子的直径大小;
B.用饱和食盐水替代水,相当于降低了水的浓度;
C.乙酸乙酯在热的NaOH溶液中会发生水解;
D.在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,硫元素由0价降低为-2价,被还原,所以硫既作氧化剂又作还原剂,根据还原产物与氧化产物的化学计量数进行判断.
解答 解:A.分散系的划分是以分散质颗粒大小来区分的,胶体粒子直径介于1nm~100nm之间,溶液溶质粒子直径小于1nm,浊液粒子直径大于100nm,溶液和浊液都不具有丁达尔效应,故A错误;
B.制取乙炔时,用饱和食盐水替代水,相当于降低了水的浓度,可减缓乙炔的产生速率,故B正确;
C.乙酸乙酯在热的NaOH溶液中会发生水解,应用饱和碳酸钠溶液收集产物以除去其中的乙酸,故C错误;
D.在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,氧化产物为K2SO3,硫元素由0价降低为-2价,被还原,还原产物为K2S,所以硫既作氧化剂又作还原剂,氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物,根据还原产物与氧化产物的化学计量数可知:作氧化剂的S原子与作还原剂的S原子的物质的量之比为2:1,故D错误;
故选B.
点评 本题考查较为综合,涉及氧化还原反应计算、物质分离与提纯、分散系分类、乙炔的制备等知识,明确氧化还原反应的实质为解答关键,注意掌握物质分离与提纯原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.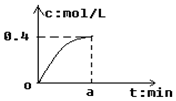 反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
 反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 5 | B. | 2.5 | C. | 7.5 | D. | 10 |
15.下列说法正确的是( )
①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同.
①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同.
| A. | ③④⑦⑧ | B. | ①③④⑦⑧ | C. | ②⑤⑥⑧⑨ | D. | ①④⑦⑨ |
12.下列说法不正确的是( )
| A. | Na2O2、HClO、SO2等物质都具有漂白作用 | |
| B. | 纯碱和小苏打都是碱 | |
| C. | 所有的置换反应都是氧化还原反应,而所有的复分解反应都是非氧化还原反应 | |
| D. | 非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应 |
19.某干电池在使用过程中发生的主要反应可用下列化学方程式表示:Zn+2MnO2+2NH4Cl(aq)═2MnO(OH)(s)+[Zn(NH3)2]Cl2(aq),其正极反应式是( )
| A. | 2MnO2+2NH4++2e-═2MnO(OH)+2NH3 | B. | Zn-2e-═Zn2+ | ||
| C. | [Zn(NH3)2]2++2e-═Zn+2NH3 | D. | Mn4++e-═Mn3+ |
16.某200mL氯化镁和氯化铝混合液中c(Mg2+)为0.3mol/L,c(Cl-)为1.2mol/L.要使Mg2+全部转化为沉淀分离出来,至少需加4mol/L NaOH溶液的体积为( )
| A. | 70 mL | B. | 60mL | C. | 80 mL | D. | 128 mL |