题目内容
6.提纯下列物质除去其中的杂质(括号中为杂质),所用试剂和方法一定正确的是( )| A. | H2SO4(HCl):AgNO3溶液、过滤 | B. | KNO3(K2SO4):Ba(NO3)2溶液、过滤 | ||
| C. | Cu(CuO):盐酸、过滤 | D. | CaCO3(CaO):加一些水、过滤 |
分析 A.二者均与硝酸银反应生成沉淀;
B.硫酸钾与硝酸钡反应生成硫酸钡沉淀、硝酸钾,但不易控制硝酸钡的用量;
C.CuO与盐酸反应,Cu不反应;
D.CaO与水反应生成氢氧化钙,氢氧化钙微溶.
解答 解:A.二者均与硝酸银反应生成沉淀,将原物质除去,故A错误;
B.硫酸钾与硝酸钡反应生成硫酸钡沉淀、硝酸钾,但不易控制硝酸钡的用量,易引入新杂质,故B错误;
C.CuO与盐酸反应,Cu不反应,则与足量盐酸反应后过滤可除杂,故C正确;
D.CaO与水反应生成氢氧化钙,氢氧化钙微溶,过滤得到的碳酸钙中易引入新杂质,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
1.在体积为2L的密闭容器中,充入6mol N2,10mol H2,发生反应:N2(g)+3H2(g)?2NH3(g)反应进行5min时,测得NH3的浓度为1mol•L-1,在此时间内,下列反应速率表示正确的是( )
| A. | v(NH3)=0.1mol•L-1•min-1 | B. | v(N2)=0.7 mol•L-1•min-1 | ||
| C. | v(NH3)=0.2mol•L-1•min-1 | D. | v(H2)=0.3mol•L-1•min-1 |
11.(l)由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
①装置乙中正极的电极反应式是Cu2++2e-═Cu.
②四种金属活动性由强到弱的顺序是D>A>B>C.
(2)由Zn一Cu一硫酸溶液组成的原电池,工作一段时间后锌片的质量减少了6.5g.回答下列问题:溶液中的H+移向正极(填“正极”或“负极’).负极的电极反应式是Zn-2e-=Zn2+,标准状况下生成2.24L气体.
| 装置 | 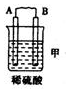 | 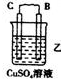 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置乙中正极的电极反应式是Cu2++2e-═Cu.
②四种金属活动性由强到弱的顺序是D>A>B>C.
(2)由Zn一Cu一硫酸溶液组成的原电池,工作一段时间后锌片的质量减少了6.5g.回答下列问题:溶液中的H+移向正极(填“正极”或“负极’).负极的电极反应式是Zn-2e-=Zn2+,标准状况下生成2.24L气体.
18.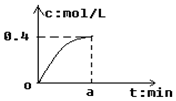 反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
 反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经a min后,SO3浓度的变化情况如图所示,在时间0-a min内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 5 | B. | 2.5 | C. | 7.5 | D. | 10 |
15.下列说法正确的是( )
①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同.
①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同.
| A. | ③④⑦⑧ | B. | ①③④⑦⑧ | C. | ②⑤⑥⑧⑨ | D. | ①④⑦⑨ |
16.某200mL氯化镁和氯化铝混合液中c(Mg2+)为0.3mol/L,c(Cl-)为1.2mol/L.要使Mg2+全部转化为沉淀分离出来,至少需加4mol/L NaOH溶液的体积为( )
| A. | 70 mL | B. | 60mL | C. | 80 mL | D. | 128 mL |

 .
. .
.