题目内容
7.将一小快钠下列溶液时,既能产生气体最终又有白色沉淀的是( )| A. | 氯化亚铁溶液 | B. | 氢氧化钠稀溶液 | C. | 硫酸铜溶液 | D. | 氯化镁溶液 |
分析 Na和水反应生成NaOH和氢气,NaOH再和部分盐反应,将一小快钠下列溶液时,既能产生气体最终又有白色沉淀,说明生成的NaOH能和盐反应生成难溶性的白色物质,据此分析解答.
解答 解:Na和水反应生成NaOH和氢气,
A.生成的NaOH和氯化亚铁反应生成灰白色氢氧化铁沉淀,但立即转化为灰绿色,最终转化为红褐色,故A不选;
B.NaOH和NaOH稀溶液不反应,故B不选;
C.硫酸铜和NaOH溶液反应生成蓝色氢氧化铜沉淀,故C不选;
D.氯化镁和NaOH溶液反应生成白色氢氧化镁沉淀,故D选;
故选D.
点评 本题考查元素化合物性质,为高频考点,明确钠、NaOH的性质是解本题关键,侧重考查学生分析判断能力,注意NaOH和氯化亚铁反应现象,题目难度不大.

练习册系列答案
相关题目
18.某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等).下列分析推理正确的是( )
| 盐酸 | 50mL | 50mL | 50mL |
| m(混合物) | 9.2g | 14.2g | 27.6g |
| V(CO2)(标准状况) | 2.2L | 3.36L | 3.36L |
| A. | 混合物中NaHCO3、KHCO的物质的量之比为1:2 | |
| B. | 当混合物质量为14.2g时,50mL盐酸恰好完全反应 | |
| C. | 盐酸的物质的量浓度为3.0mol/L | |
| D. | 9.2g混合物加热,固体质量减少2.2g |
15.下列依据相关实验得出的结论正确的是( )
| A. | 向某溶液中加入先加氯水,再加KSCN溶液后显红色,该溶液中一定含Fe2+ | |
| B. | 向某溶液中加入硝酸酸化的硝酸银溶液,出现白色沉淀,该溶液中一定含Cl- | |
| C. | 向某溶液中加入盐酸酸化的氯化钡溶液,出现白色沉淀,该溶液中一定含SO42- | |
| D. | 向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液中一定含CO32- |
2.用下列实验装置完成对应实验(部分仪器已省略)不能达到实验目的是( )
| A. | 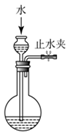 检查装置气密性 | |
| B. |  实验室制氨气 | |
| C. | 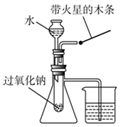 验证过氧化钠与水反应即生成氧气又放热 | |
| D. |  分离苯和水 |
12.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 在标准状况下,11.2LNO与11.2LO2混合后气体分子数为0.75NA | |
| B. | 7.8gNa2O2与足量的CO2反应时转移的电子数为0.2NA | |
| C. | 1L 1 mol/L的醋酸溶液中所含离子总数为2NA | |
| D. | 常温常压下,16gO3所含的原子数为NA |
19.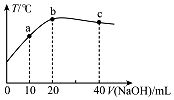 在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
 在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.01000mol•L-1的醋酸溶液中逐滴加入0.01000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )| A. | 若a点溶液呈酸性,则a点有:c(CH3COO-)>c(Na+)>c(CH3COOH) | |
| B. | 从b到c:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | 水的电离程度:b点<c点 | |
| D. | b点有0.01000mol•L-1+c(H+)=c(Na+)-c(CH3COOH)+c(OH-) |
16. N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 .
.
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”、“不变”).
②下表为反应在T1温度下的部分实验数据:
则500s内N2O5的分解速率为0.00296 mol•L-1•s-1.
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1.(填>、<或=)
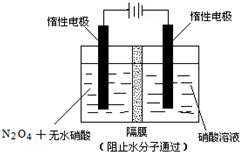
(3)如图所示装置可用于制备N2O5,则N2O5在电解池的阳极区生成,其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是
 .
.(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”、“不变”).
②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1.(填>、<或=)
(3)如图所示装置可用于制备N2O5,则N2O5在电解池的阳极区生成,其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
17.某有机物的结构简式如图所示,有关该有机物的叙述不正确的是( )


| A. | 在一定条件下,能发生取代、氧化、酯化反应 | |
| B. | 1 mol该物质最多可与2 molNa反应 | |
| C. | 1 mol该物质最多可与4 mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |