题目内容
6.在强酸性的无色溶液中能大量共存的离子组是( )| A. | Ba2+、K+、OH-、NO3- | B. | NH4+、Mg2+、SO42-、Cl- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、CO32- |
分析 强酸性溶液含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.酸性溶液中不能大量存在OH-,故A不选;
B.酸性溶液中该组离子之间不反应,可大量共存,且离子均为无色,故B选;
C.Cu2+为蓝色,与无色不符,故C不选;
D.Ca2+、CO32-结合生成沉淀,H+、CO32-结合生成水和气体,不能共存,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
14.一定温度下,可逆反应H2(g)+I2(g)?2HI(g)达到化学平衡状态的标志是( )
| A. | 混合气体的颜色不再变化 | B. | 混合气体的压强不再变化 | ||
| C. | 反应速率v(H2)=$\frac{1}{2}$v(HI) | D. | c(H2):c(I2):c(HI)=1:1:2 |
1.下列离子方程式书写正确的是( )
| A. | 氧化钠与水反应:Na2O+H2O═Na++OH- | |
| B. | 氯化铝溶液与足量氨水反应:Al3++4OH-═AlO2-+2H2O | |
| C. | 氯化铝溶液与足量NaOH溶液反应:Al3++3OH-═Al(OH)3↓ | |
| D. | 氧化铝和适量的烧碱溶液反应:Al2O3+2OH-═2AlO2-+H2O |
11.化学在生产和日常生活中有着重的应用.下列说法不正确的是( )
| A. | 明矾在水中形成的AI(OH)3胶体能吸收水中悬浮物,可用于水的净化 | |
| B. | Sio2是良好的半导体材料,常用于制造计算机的芯片 | |
| C. | Fe2O3俗称铁红,常用作红色的油漆和涂料 | |
| D. | 浓硫酸在常温下可用铁制容器保存 |
18.某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等).下列分析推理正确的是( )
| 盐酸 | 50mL | 50mL | 50mL |
| m(混合物) | 9.2g | 14.2g | 27.6g |
| V(CO2)(标准状况) | 2.2L | 3.36L | 3.36L |
| A. | 混合物中NaHCO3、KHCO的物质的量之比为1:2 | |
| B. | 当混合物质量为14.2g时,50mL盐酸恰好完全反应 | |
| C. | 盐酸的物质的量浓度为3.0mol/L | |
| D. | 9.2g混合物加热,固体质量减少2.2g |
15.下列依据相关实验得出的结论正确的是( )
| A. | 向某溶液中加入先加氯水,再加KSCN溶液后显红色,该溶液中一定含Fe2+ | |
| B. | 向某溶液中加入硝酸酸化的硝酸银溶液,出现白色沉淀,该溶液中一定含Cl- | |
| C. | 向某溶液中加入盐酸酸化的氯化钡溶液,出现白色沉淀,该溶液中一定含SO42- | |
| D. | 向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液中一定含CO32- |
16.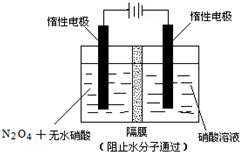 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 .
.
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”、“不变”).
②下表为反应在T1温度下的部分实验数据:
则500s内N2O5的分解速率为0.00296 mol•L-1•s-1.
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1.(填>、<或=)
(3)如图所示装置可用于制备N2O5,则N2O5在电解池的阳极区生成,其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是
 .
.(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”、“不变”).
②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1.(填>、<或=)
(3)如图所示装置可用于制备N2O5,则N2O5在电解池的阳极区生成,其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
 ,则该分子中含有碳碳三键的数目为( )
,则该分子中含有碳碳三键的数目为( )