题目内容
13.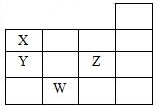 如图表示元素周期表的一部分,关于元素X、Y、Z、W的叙述正确的是( )
如图表示元素周期表的一部分,关于元素X、Y、Z、W的叙述正确的是( )①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性为Y<Z
③W的单质是半导体材料
④W的原子序数比Y大9.
| A. | 只有③ | B. | 只有①③ | C. | 只有①②③ | D. | ①②③④ |
分析 由元素在周期表的位置可知,X为第二周期第ⅤA族元素,为N元素,Y为P,Z为Cl元素,W为Se元素,
①非金属性越强,最高价氧化物的含氧酸的酸性越强;
②非金属性越强,气态氢化物越稳定;
③W为Se元素,其单质为半导体材料;
④W为Se元素,原子序数为34,Y的原子序数为15.
解答 解:由元素在周期表的位置可知,X为第二周期第ⅤA族元素,即X为N,则Y为P,Z为Cl元素,W为Se元素,
①非金属性X>Y,最高价氧化物的含氧酸的酸性强弱Y<X,故①正确;
②非金属性Z>Y,气态氢化物的稳定性Y<Z,故②正确;
③W为Se元素,Se是最早得到实际应用的元素半导体材料,故③正确;
④Se的质子数为34,P的质子数为15,则W的原子序数比Z大34-15=19,故④错误;
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,熟悉元素在周期表中的位置及元素的性质是解答本题的关键,试题有利于提高学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列分子或离子的中心原子,带有一对孤电子对的是( )
| A. | H2O | B. | BeCl2 | C. | CH4 | D. | PCl3 |
1.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | NA个N2分子与NA个CO分子的质量比为1﹕1 | |
| B. | 水的摩尔质量等于NA个水分子的质量 | |
| C. | 在常温常压下,11.2LSO2含有的分子数为0.5NA | |
| D. | 1L 0.1mol•L-1Na2SO4溶液中有0.1NA个Na+ |
8.一定量的某有机物完全燃烧,生成0.2mol CO2和5.4g H2O,该有机物不可能是( )
| A. | CH≡CH | B. | CH3CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
3.现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)B为Ba(OH)2溶液,C为HCl 溶液(填化学式)
(2)写出A溶液与E溶液反应的化学方程式:3Na2CO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CO2↑+3Na2SO4.
(3)写出E溶液与过量的B溶液反应的离子方程式:2A13++3SO42-+3Ba2++8OH-=2A1O2-+3BaSO4↓+4H2O.
(4)已知:NaOH(aq)+HNO3(aq)=NaNO3 (aq)+H2O(1)△H=-akJ•mol-1.请写出B与C的稀溶液反
应的热化学方程式OH-(aq)+H+(aq)=H2O(1)△H=-a kJ/mol或1/2Ba(OH)2(aq)+HC1(aq)=1/2BaC12(aq)+H2O(1)△H=-a kJ/mol或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2akJ/mol.
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)B为Ba(OH)2溶液,C为HCl 溶液(填化学式)
(2)写出A溶液与E溶液反应的化学方程式:3Na2CO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CO2↑+3Na2SO4.
(3)写出E溶液与过量的B溶液反应的离子方程式:2A13++3SO42-+3Ba2++8OH-=2A1O2-+3BaSO4↓+4H2O.
(4)已知:NaOH(aq)+HNO3(aq)=NaNO3 (aq)+H2O(1)△H=-akJ•mol-1.请写出B与C的稀溶液反
应的热化学方程式OH-(aq)+H+(aq)=H2O(1)△H=-a kJ/mol或1/2Ba(OH)2(aq)+HC1(aq)=1/2BaC12(aq)+H2O(1)△H=-a kJ/mol或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2akJ/mol.
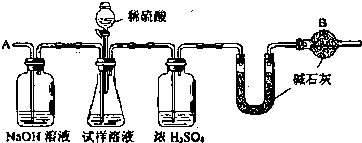
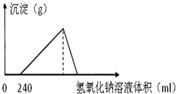 将5.1g的氧化铝溶于一定浓度的500mL的盐酸中,充分反应后,再逐滴加入0.5mol/L的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算:
将5.1g的氧化铝溶于一定浓度的500mL的盐酸中,充分反应后,再逐滴加入0.5mol/L的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算: