题目内容
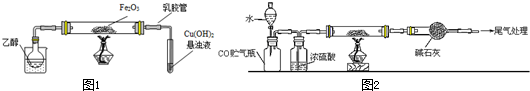
1.某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物(1)用2%的CuSO4溶液和10%的NaOH溶液配制Cu(OH)2悬浊液的注意事项是在过量NaOH溶液中滴加数滴CuSO4溶液.
(2)为快速得到乙醇气体,可采取的方法是在烧杯中加入热水(对烧杯加热);若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是c(填字母);
a.取下小试管 b.移去酒精灯
c.将导管从乳胶管中取下 d.以上都可以.
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热.取下小试管,加热,有砖红色沉淀生成,小试管中发生反应的化学方程式是CH3CHO+2Cu(OH)2$\stackrel{△}{→}$Cu2O↓+CH3COOH+2H2O.
(4)为了检验M的组成,进行下列实验.
①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
②经检验溶液中有铁离子和亚铁离子,检验铁离子的方法是取少量溶液加入KSCN溶液,变红色,则有Fe3+;能得出的结论是b(填写编号).
a.一定有+3价和+2价铁,无0价铁 b.一定有+3价,0价和+2价铁至少有一种
c.一定有+3价和0价铁,无+2价铁 d.一定有+3价、+2价和0价铁.
(5)若M的成份可表达为FexOy,用CO还原法定量测定其化学组成.称取agM样品进行定量测定,实验装置如图2,步骤如下:
①组装仪器;②点燃酒精灯;③加入试剂;④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧….正确的操作顺序是c(填写编号)
a.①⑤④③②⑥⑦⑧b.①③⑤④②⑦⑥⑧
c.①⑤③④②⑥⑦⑧d.①③⑤②④⑥⑦⑧
(6)若M完全还原后,碱石灰增重mg,则FexOy中$\frac{x}{y}$=$\frac{11a-4m}{4m}$.(用含m,n的代数式表示)
分析 (1)新制氢氧化铜浊液需要氢氧化钠溶液过量,在碱性溶液中才会和醛基反应生成氧化亚铜红色沉淀;
(2)依据图1装置分析可知,乙醇易挥发,可以对烧杯加热或烧杯中加入热水;阻止倒吸的操作是迅速拆下导气管;
(3)依据反应现象可知,乙醇蒸气在氧化铁做催化剂作用下生成乙醛,试管内发生的是乙醛和氢氧化铜加热反应生成红色氧化亚铜沉淀;
(4)依据铁离子的实验检验方法分析,铁离子加入硫氰酸钾溶液会变红色;乙醇和氧化铁反应过程中可能会生成铁或四氧化三铁,能被磁铁吸引;
(5)实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水吧一氧化碳赶入后续装置,点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比;
(6)依据实验结果得到,碱石灰增重mg,即吸收二氧化碳为mg,则铁的氧化物中减少的质量为氧元素的质量为$\frac{16}{44}$mg=$\frac{4}{11}$mg,铁的质量为(a-$\frac{4}{11}$m)g,依据元素物质的量计算得到比值.
解答 解:(1)新制氢氧化铜浊液需要氢氧化钠溶液过量,在碱性溶液中才会和醛基反应生成氧化亚铜红色沉淀,制备过程为在过量NaOH溶液中滴加数滴CuSO4溶液,
故答案为:在过量NaOH溶液中滴加数滴CuSO4溶液;
(2)依据图1装置分析可知,乙醇易挥发,可以对烧杯加热或烧杯中加入热水;阻止倒吸的操作是迅速拆下导气管,
故答案为:在烧杯中加入热水(对烧杯加热);c;
(3)依据反应现象可知,乙醇蒸气在氧化铁做催化剂作用下生成乙醛,试管内发生的是乙醛和氢氧化铜加热反应生成红色氧化亚铜沉淀,反应的化学方程式为:CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$Cu2O↓+CH3COOH+2H2O;
故答案为:CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$Cu2O↓+CH3COOH+2H2O;
(4)依据铁离子的实验检验方法分析,铁离子加入硫氰酸钾溶液会变红色,取少量溶液加入KSCN溶液,变红色,则有Fe3+;氧化铁做催化剂参与反应过程,乙醇和氧化铁反应过程中可能会生成铁或四氧化三铁,能被磁铁吸引;
故答案为:取少量溶液加入KSCN溶液,变红色,则有Fe3+;b;
(5)实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比,所以选c,
故答案为:c;
(6)依据实验结果得到,碱石灰增重mg,即吸收二氧化碳为mg,则铁的氧化物中减少的质量为氧元素的质量为$\frac{16}{44}$mg=$\frac{4}{11}$mg,铁的质量为(a-$\frac{4}{11}$m)g,依据元素物质的量计算得到比值,n(Fe):n(O)=(a-$\frac{4}{11}$m):$\frac{4}{11}$m=$\frac{11a-4m}{4m}$,
故答案为:$\frac{11a-4m}{4m}$.
点评 本题考查了物质性质的实验探究和物质组成的分析判断,实验操作步骤的设计和完善,实验过程中的反应实质分析判断,现象的理解和应用是解题关键,题目难度中等.


| A. | 用1从碘水中分离出碘 | B. | 用2检验试液中NH4+的存在 | ||
| C. | 用3干燥SO2气体 | D. | 用4收集HCl气体 |
| A. | 乙醇脱水 | B. | 石油分离 | C. | 石油裂化 | D. | 石油裂解 |
| A. | 3:2 | B. | 1:2 | C. | 2:1 | D. | 2:3 |
| A. | 铜片插入FeCl3溶液中:Cu+2Fe3+═Cu2++2 Fe2+ | |
| B. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 烧碱溶液中加铝片:2Al+2OH-+2H2O═2 AlO2-+3H2↑ | |
| D. | 铁粉与稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ |

| A. | 9 | B. | 10 | C. | 11 | D. | 12 |
| A. | 加水 | B. | 加盐酸 | C. | 加热 | D. | 加醋酸钠晶体 |
2Fe+3Br2═2FeBr3,2FeBr3$\frac{\underline{\;\;△\;\;}}{\;}$2FeBr2+Br2↑,
最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.
请回答:

(1)仪器d的名称分液漏斗.
(2)导入的CO2不干燥,会在E中发生副反应,其含铁副产物为Fe3O4;若所得产物中含此副产物,用化学方法检验.下列方案合理的是B.
A.取少量产物于试管中加入稀盐酸,再加入KSCN溶液
B.取少量产物于硬质大试管中,通入氢气,排尽空气后加热,用CuSO4检验生成的水蒸气
C.用磁铁吸引,看产物能否被吸引
D.取少量产物于试管中加入蒸馏水,过滤看是否有黑色不溶物
(3)为防止污染空气,实验时应在F处连接盛有NaOH溶液的尾气吸收装置,反应的化学方程式:2NaOH+Br2=NaBr+NaBrO+H2O.
(4)取产品10g配制成250mL溶液,取出25.00mL用酸性KMnO4溶液滴定溶液中的Fe2+,用去0.03000mol/L酸性KMnO4溶液25.00mL,则产品的纯度为81%.
(5)利用除去杂质后的FeBr2可以验证Cl2、Fe3+、Br2的氧化性强弱.将你设计的实验操作、预计的实验现象和实验结论(氧化性强弱)填写在下列表空格内:
| 实验操作 | 实验现象 | 氧化性强弱 |
| ①取一定量FeBr2溶于水,加入少量(或几滴)氯水(或通入少量氯气),加入KSCN溶液 | 溶液呈血红色 | ②Cl2>Fe3+ Br2>Fe3+ |
| ③取少量FeBr2溶于水,加入过量氯水(或通入足量氯气),加入四氯化碳,震荡 | ④四氯化碳层呈棕红色 | Cl2>Br2 |
 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下: