题目内容
有一结晶水合物X?6H2O,其水溶液为浅绿色,可发生如图的转化(部分反应物、生成物从略).其中B、D、E、F均为无色气体,G为难溶于水的红褐色固体.在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀.
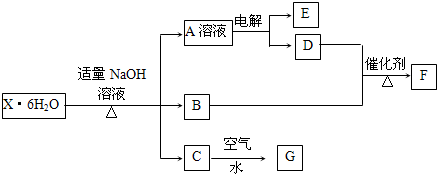
请回答下列问题:
(1)指出C→G的基本反应类型: 反应.
(2)用惰性电极电解溶液A时得到E的电极反应式为 .
(3)B与D反应生成F的化学方程式为 .
(4)该晶体水合物的化学式为 .

请回答下列问题:
(1)指出C→G的基本反应类型:
(2)用惰性电极电解溶液A时得到E的电极反应式为
(3)B与D反应生成F的化学方程式为
(4)该晶体水合物的化学式为
考点:无机物的推断
专题:推断题
分析:X的水溶液为浅绿色,说明X含有亚铁离子,碱性条件下生成的B为NH3,G为难溶于水的红褐色固体,应为Fe(OH)3,
则C为Fe(OH)2,在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,说明X中含有SO42-,应为Na2SO4溶液,电解生成氢气和氧气,能与氨气反应的D为O2,则E为H2,F为NO,结合对应物质的性质以及题目要求解答该题.
则C为Fe(OH)2,在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,说明X中含有SO42-,应为Na2SO4溶液,电解生成氢气和氧气,能与氨气反应的D为O2,则E为H2,F为NO,结合对应物质的性质以及题目要求解答该题.
解答:
解:X的水溶液为浅绿色,说明X含有亚铁离子,碱性条件下生成的B为NH3,G为难溶于水的红褐色固体,应为Fe(OH)3,则C为Fe(OH)2,在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,说明X中含有SO42-,应为Na2SO4溶液,电解生成氢气和氧气,能与氨气反应的D为O2,则E为H2,F为NO,
(1)由以上分析可知C→G的反应为氢氧化亚铁的氧化反应,反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,为化合反应,故答案为:化合;
(2)用惰性电极电解溶液A时得到E的电极反应式为阴极反应生成氢气,电极方程式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)B与D反应生成F的反应为氨气的催化氧化,化学方程式为4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(4)由以上分析可知X中含有NH4+、Fe2+和SO42-,应为(NH4)2Fe(SO4)2?6H2O,故答案为:(NH4)2Fe(SO4)2?6H2O.
(1)由以上分析可知C→G的反应为氢氧化亚铁的氧化反应,反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,为化合反应,故答案为:化合;
(2)用惰性电极电解溶液A时得到E的电极反应式为阴极反应生成氢气,电极方程式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)B与D反应生成F的反应为氨气的催化氧化,化学方程式为4NH3+5O2
| ||
| △ |
| ||
| △ |
(4)由以上分析可知X中含有NH4+、Fe2+和SO42-,应为(NH4)2Fe(SO4)2?6H2O,故答案为:(NH4)2Fe(SO4)2?6H2O.
点评:本题考查无机物的推断,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握物质的特性以及用途,为推断题目的突破口,明确物质的种类为解答该题的关键,难度中等,注意物质的性质的学习.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 如图表示25℃时,0.1mol/L的一元弱酸HA加水稀释过程中,某量随加水量变化情况,则图中纵坐标y可以是( )
如图表示25℃时,0.1mol/L的一元弱酸HA加水稀释过程中,某量随加水量变化情况,则图中纵坐标y可以是( )| A、溶液的pH | ||
| B、Ka(HA) | ||
C、
| ||
D、
|
下列离子方程式书写正确的是( )
| A、在澄清石灰水中通入过量CO2:CO2+2OH-=CO32-+H2O | ||||
B、用惰性电极电解Cu(NO3)2溶液:Cu2++2OH-
| ||||
| C、将足量Cl2通入到FeI2溶液中:3Cl2+2Fe2++4I-=2I2+6Cl-+2Fe3+ | ||||
| D、金属Al溶于氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑ |
 一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响如图所示.下列判断不正确的是( )
一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响如图所示.下列判断不正确的是( )| A、Cu2+、Mn2+提高乙酸降解速率的最佳浓度为0.1 mol?L-l |
| B、Fe3+不能提高乙酸降解速率 |
| C、相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的降解速率依次减小 |
| D、该实验方案的缺陷之一是未做空白对照实验 |
Li-Al/FeS电池是一种正在开发的车载电池,它的电池总反应方程式为:2Li+FeS=Li2S+Fe,有关该电池的下列说法中,不正确的是( )
| A、该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe |
| B、Li-Al合金在电池中作为负极材料 |
| C、负极的电极反应式为Al-3e-=Al3+ |
| D、充电时,阳极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS |
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、1.0L1.0mol?L-1CH3COOH溶液中,CH3COOH分子数为NA |
| B、1 molNa2O2与足量H2O反应转移的电子数NA |
| C、常温常压下,22.4L的D2、H2组成的气体分子数约为NA |
| D、4.6g NO2和N2O4的混合物所含的分子数为NA |
常温下,下列各组离子在指定溶液中一定能大量两共存的是( )
| A、水电离产生的c(H+)=10-12的溶液:K+、Na+、ClO-、I- |
| B、c(H+)/c(OH-)=10-12的溶液:K+、AlO2-、CO32-、Na+ |
| C、硫化钠溶液:Cu2+、SO32-、Br-、H+ |
| D、pH=13的溶液:AlO2-、Cl-、HCO3-、SO42- |
已知外电路中,电子由铜流向a极.有关如图所示的装置分析合理的一项是( )


| A、该装置中Cu极为正极 |
| B、当铜极的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为2.24L |
| C、一段时间后锌片质量减少 |
| D、B极反应的电极反应式为:H2-2e-=2H+ |