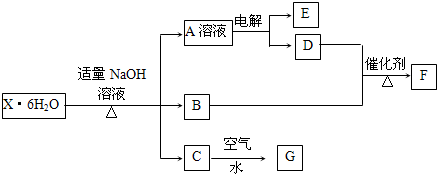
题目内容
 如图表示25℃时,0.1mol/L的一元弱酸HA加水稀释过程中,某量随加水量变化情况,则图中纵坐标y可以是( )
如图表示25℃时,0.1mol/L的一元弱酸HA加水稀释过程中,某量随加水量变化情况,则图中纵坐标y可以是( )| A、溶液的pH | ||
| B、Ka(HA) | ||
C、
| ||
D、
|
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:0.1mol/L的一元弱酸HA加水稀释过程中,促进电离,n(H+)增大,溶液的体积增大,而且溶液体积增大的程度比物质的量增大的快,所以c(H+)减小,电离常数只与温度有关;由图象可知随着水的量增大,y减小,结合选项分析.
解答:
解:A、0.1mol/L的一元弱酸HA加水稀释过程中,促进电离,n(H+)增大,溶液的体积增大,而且溶液体积增大的程度比物质的量增大的快,所以c(H+)减小,则pH增大,与图象不符,故A错误;
B、弱电解质的电离常数只与温度有关,改变浓度Ka不变,与图象不符,故B错误;
C、由A项分析可知,随着溶液的体积增大,c(H+)减小,即c(H+)=
减小,与图象变化一致,故C正确;
D、已知Kw=c(H+)?c(OH-),Ka=
,由
=
,已知Ka和Kw均为常数,所以
不变,与图象不符,故D错误;
故选C.
B、弱电解质的电离常数只与温度有关,改变浓度Ka不变,与图象不符,故B错误;
C、由A项分析可知,随着溶液的体积增大,c(H+)减小,即c(H+)=
| KW |
| c(OH-) |
D、已知Kw=c(H+)?c(OH-),Ka=
| c(A-)?c(H+) |
| c(HA) |
| Ka |
| Kw |
| c(A-) |
| c(HA)?c(OH-) |
| c(A-) |
| c(HA)?c(OH-) |
故选C.
点评:本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,注意酸的电离平衡常数、水的离子积常数只与温度有关,与溶液的浓度无关,为易错点.

练习册系列答案
相关题目
下列过程所包含的有机化学反应中,不属于氧化反应的是( )
| A、烯烃使酸性高锰酸钾溶液褪色 |
| B、在家中燃烧液化石油气做饭 |
| C、乙酸与乙醇反应生成乙酸乙酯 |
| D、用装有酸性重铬酸钾的装置检验司机是否酒后驾车 |
下列实验操作能够达到实验目的是( )
| A、用激光笔鉴别淀粉溶液和蔗糖溶液 |
B、 实验室采用如图所示装置收集SO2 实验室采用如图所示装置收集SO2 |
| C、除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤 |
| D、配制一定物质的量浓度溶液时,容量瓶用蒸馏水洗涤后再用待装溶液润洗 |
 小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究.
小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究.