题目内容
12. 学习化学应该明确“从生活中来,到生活中去”的道理.
学习化学应该明确“从生活中来,到生活中去”的道理.(1)金币、铜币等金属货币在我国历史上曾发挥过重要的作用,若将金币、铜币分别放到稀硝酸中浸泡,能溶解的是铜币,写出溶解时的离子方程3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)铝是一种较活泼的金属,在生产生活中有广泛的应用,铝与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,因此铝制容器不能盛装NaOH溶液.
(3)氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量)
①d过程中,可以观察到先变红后褪色,说明饱和氯水中含有H+、HClO(填化学符号).
②生产84消毒液对应的是c(填“a”、“b”、“c”、“d”或“e”).发生的离子反应方程式为Cl2+2OH-=Cl-+ClO-+H2O
③a过程的现象为溶液分层、且下层为深红色.由此可得,氧化性Cl2>Br2.
(4)硅石重要的半导体材料,工业上生产粗硅的反应方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
分析 (1)Cu与硝酸反应,而金不能;
(2)铝与NaOH溶液反应生成偏铝酸钠和氢气;
(3)将氯气溶于水,部分氯气与水反应:Cl2+H2O?HCl+HClO,得到氯水(浅黄绿色),氯水含多种微粒,其中有H2O、Cl2、HClO、Cl-、H+、OH-(极少量,水微弱电离出来的),其性质取决于其组成的微粒.
①强氧化性:氯气能氧化与KI,KBr、FeCl2、SO2、Na2SO3等物质;
②漂白、消毒性:氯水中的Cl2和HClO均有强氧化性,一般在应用其漂白和消毒时,应考虑HClO,HClO的强氧化性将有色物质氧化成无色物质,不可逆;
③酸性:氯水中含有HCl和HClO,故可被NaOH中和,盐酸还可与NaHCO3,CaCO3等反应;
④不稳定性:HClO不稳定光照易分解. 因此久置氯水(浅黄绿色)会变成稀盐酸(无色)失去漂白性;
⑤沉淀反应:加入AgNO3溶液有白色沉淀生成(氯水中有Cl-);
(4)高温下,碳还原二氧化硅制备粗硅.
解答 解:(1)将金币、铜币分别放到稀硝酸中浸泡,能溶解的是铜币,发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,溶解时的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:铜币;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)铝与NaOH溶液反应生成偏铝酸钠和氢气,反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)①d过程中,可以观察到紫色石蕊先变红后褪色,说明饱和氯水中含有H+、HClO,故答案为:先变红后褪色;H+、HClO;
②氯气与NaOH反应生产84消毒液,对应的是c.发生的离子反应方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:c;Cl2+2OH-=Cl-+ClO-+H2O;
③Cl2是新制氯水的主要成分,具有强氧化性,与KBr发生2KBr+Cl2 ═2KCl+Br2,四氯化碳层在下层为深红色,a过程的现象为溶液分层、且下层为深红色,由此可得,氧化性为Cl2>Br2,故答案为:溶液分层、且下层为深红色;Cl2;Br2;
(4)高温下,碳还原二氧化硅制备粗硅,其反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
点评 本题考查常见金属及化合物、非金属及化合物的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | Na2O2与H2O反应:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | AlCl3溶液中滴加过量的氨水:Al3++4 NH3•H2O═AlO2-+2H2O+4NH4+ | |
| C. | 铜与浓硝酸反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 向小苏打溶液中滴入醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
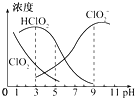 亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )
亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )| A. | 25℃时HClO2的电离平衡常数Ka=10-6 | |
| B. | 使用漂白剂的最佳pH为3 | |
| C. | 25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合混合溶液中c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) | |
| D. | 25℃时 用0.1000mol/LNaOH溶液滴定20.00ml某未知浓度的HClO2溶液 当滴入NaOH溶液体积为20.00ml时溶液呈中性 则HClO2溶液的实际浓度为0.11mol/L |
| A. | CH3COONa的溶液:CH3COO-+H2O═CH3COOH+OH- | |
| B. | NH4Cl的溶液:NH4++H2O?NH3•H2O+H+ | |
| C. | Na2CO3的溶液:CO32-+H2O?H2CO3+2OH- | |
| D. | AlCl3的溶液:Al3++3H2O═Al(OH)3↓+3H+ |
| A. | 纯锌与稀硫酸 | B. | 粗锌与稀硝酸 | C. | 纯锌与浓硫酸 | D. | 粗锌与稀硫酸 |
| A. |  | B. |  | C. |  | D. |  |
| A. | △S>0,△H>0 | B. | △S<0,△H<0 | C. | △S<0,△H>0 | D. | △S>0,△H<0 |

 (1)FeCl3具有净水作用,但腐蚀设备,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
(1)FeCl3具有净水作用,但腐蚀设备,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
