题目内容
1.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/molNa2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}{{O}_2}({g})$△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为566 kJ/mol | |
| B. | 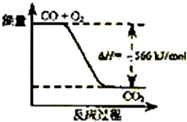 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<-452 kJ/mol | |
| D. | CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为4NA |
分析 A、依据燃烧热的概念分析计算判断;
B、2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol,表示2mol的一氧化碳完全反应生成2mol的二氧化碳放出热量;
C、根据热化学方程式中热量与物质的量之间的关系、物质由固态变气态吸收热量以及盖斯定律来解答;
D、据所给热化学方程式分析;
解答 解;A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为KJ/mol,CO的燃烧热为283kJ/mol,故A错误;
B、2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol,表示2mol的一氧化碳完全反应生成2mol的二氧化碳放出热量,则生成物能量比反应物能量低,故B正确;
C、题目中第二个方程的2倍为:2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452 kJ/mol,本题中的CO2(s)多一步变气体吸热的过程,所以本题放出的热量就少于452,但是△H>-452 kJ/mol,故C错误;
D、反应Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1,每有1molNa2O2(s)反应.转移1mol电子,放热226KJ,所以反应放出452kJ热量时,电子转移数为2NA,故D错误;
故选B.
点评 本题主要考查了燃烧热的概念、单位、盖斯定律等知识,试题的综合性较强,有一定的难度.

练习册系列答案
相关题目
1.三聚氰胺是其结构式如图所示.下列关于三聚氰胺的说法不正确的是( )


| A. | 三聚氰胺的分子式为C3H6N6 | |
| B. | 三聚氰胺分子中的所有原子均位于同一平面上 | |
| C. | 三聚氰胺的一取代物只有一种 | |
| D. | 三聚氰胺不属于芳香烃 |
12.下列事实不能用勒夏特列原理解释的是( )
| A. | 实验室可用排饱和食盐水的方法收集氯气 | |
| B. | 将氯化铜溶液加热蒸干最终得不到氯化铜固体 | |
| C. | 钢铁在潮湿的空气中容易生锈 | |
| D. | 常温下,Ksp(MnS)>Ksp(CuS),工业上可用MnS除去废水中的Cu2+ |
9.金属钠分别投入下列溶液中,放出气体且最终不一定有沉淀的是( )
| A. | MgCl2溶液 | B. | CuSO4溶液 | C. | FeCl3溶液 | D. | Al2(SO4)3溶液 |
10.下列实验装置设计正确、且能达到目的是( )
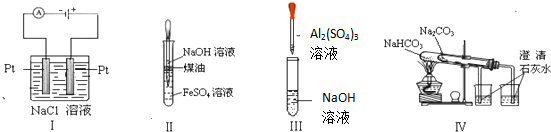

| A. | 实验Ⅰ:制取金属钠 | B. | 实验II:制取Fe(OH)2 | ||
| C. | 实验Ⅲ:制取少量的氢氧化铝 | D. | 实验Ⅳ:比较两种物质的热稳定性 |
11.下列有关热化学方程式书写及对应表述均正确的是( )
| A. | 已知2C(s)+O2 (g)═2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/mol | |
| B. | 稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ/mol | |
| D. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ/mol |
