题目内容
6.(1)标准状况下4.48L 的HCl气体质量为7.3g.将该气体溶于水配成100ml溶液所得溶液中Cl-的物质量的浓度为2mol/L.若将配成的100ml溶液稀释至500ml,所得溶液的物质的量浓度为0.5mol/L.(2)实验室可用MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O制备氯气,请回答以下问题:
①该反应的氧化剂是MnO2,氧化产物是Cl2,反应过程中若转移0.2NA个电子,则产生的氯气在标准状况下的体积为2.24L.
②实验室中也可以用以下反应制备氯气:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O 对比两种制备氯气的方法可知氧化性强弱:KMnO4>MnO2填符号(“>”“<”“=”).
(3)金属钙在一定条件下可以与氢气化合生成CaH2(白色固体).将该白色固体加入滴有酚酞的蒸馏水中,可以观察到有气泡生成,溶液变红.请根据以上事实书写CaH2与水反应的化学方程式CaH2+2H2O=Ca(OH)2+2H2↑.
分析 (1)结合n=$\frac{V}{Vm}$、m=nM、c=$\frac{n}{V}$及稀释前后溶质的物质的量不变计算;
(2)①MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,Cl元素的化合价升高,该反应生成1mol气体转移2mol电子;
②2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,结合反应条件分析;
(3)由现象可知生成氢气和碱.
解答 解:(1)标准状况下4.48L 的HCl气体质量为$\frac{4.48L}{22.4L/mol}$×36.5g/mol=7.3g.将该气体溶于水配成100ml溶液所得溶液中Cl-的物质量的浓度为$\frac{\frac{4.48L}{22.4L/mol}}{0.1L}$=2mol/L.若将配成的100ml溶液稀释至500ml,所得溶液的物质的量浓度为$\frac{2mol/L×0.1L}{0.5L}$=0.4mol/L,
故答案为:7.3;2;0.5;
(2)①MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,Cl元素的化合价升高,该反应生成1mol气体转移2mol电子,则该反应的氧化剂是MnO2,氧化产物是Cl2,反应过程中若转移0.2NA个电子,则产生的氯气在标准状况下的体积为0.1mol×22.4L/mol=2.24L,
故答案为:MnO2;Cl2;2.24;
②2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,氧化剂为KMnO4,该反应常温下进行,则可知氧化性强弱:KMnO4>MnO2,故答案为:>;
(3)由现象可知生成氢气和碱,CaH2与水反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑,故答案为:CaH2+2H2O=Ca(OH)2+2H2↑.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化及物质的量计算的相关公式为解答的关键,侧重氧化还原反应基本概念及分析与计算能力的考查,题目难度不大.

| A. | 用NaOH溶液鉴别(NH4)2SO4和NH4Cl | |
| B. | 用AgNO3溶液鉴别NaBr溶液和KI溶液 | |
| C. | 用焰色反应鉴别NaCl和NaNO3 | |
| D. | 用澄清石灰水鉴别CO2和SO2 |
| A. | CH3CH2CH(CH3)2属于链状化合物 | B. |  属于芳香化合物 属于芳香化合物 | ||
| C. |  属于脂环化合物 属于脂环化合物 | D. |  属于芳香化合物 属于芳香化合物 |
| A. | c(H+)=10-13mol/L的溶液中:NO3-、SO42-、K+、Na+ | |
| B. | 含Fe3+的溶液中中:Na+、K+、CH3COO-、HCO3- | |
| C. | 铁与过量稀硫酸反应后的溶液中:[Al(OH)4]-、NH4+、Cl-、NO3- | |
| D. | 空气中:SO2、NO、N2、NH3 |
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}{{O}_2}({g})$△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为566 kJ/mol | |
| B. | 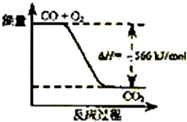 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<-452 kJ/mol | |
| D. | CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为4NA |
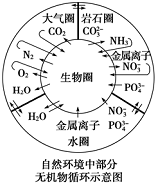
| A. | 金属离子和硝酸根离子进入生物圈可能形成环境污染 | |
| B. | 碳元素在自然界中的循环主要是通过CO2的生成和消耗来实现的 | |
| C. | 自然界中不存在硫及其化合物的循环,因为在示意图中没能体现 | |
| D. | 雷雨天氮气和氧气的反应属于自然固氮的一种方式 |

| A. | 该分子中有6个手性碳原子 | |
| B. | 它的分子式为C15H22O5 | |
| C. | 因其具有过氧基团,它不稳定,易受湿、热和还原性物质的影响而变质 | |
| D. | 它在常见有机溶剂中的溶解度大于在水中的溶解度 |
 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .A与浓H2SO4混合,在一定条件下反应生成六元环状物B,B的结构简式
.A与浓H2SO4混合,在一定条件下反应生成六元环状物B,B的结构简式 .
.