题目内容
11.下列有关热化学方程式书写及对应表述均正确的是( )| A. | 已知2C(s)+O2 (g)═2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/mol | |
| B. | 稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ/mol | |
| D. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ/mol |
分析 A、燃烧热生成稳定的氧化物,而不是一氧化碳;
B、醋酸为弱电解质,电离吸热;
C、已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+571kJ.mol-1;
D、密闭容器中,9.6g硫粉物质的量为0.3mol,与11.2g铁粉物质的量为0.2mol混合加热生成硫化亚铁17.6g时,硫过量,放出19.12kJ热量,所以1mol铁反应放热=19.12KJ×$\frac{1}{0.2}$=95.6KJ,由此分析解答.
解答 解:A、燃烧热生成稳定的氧化物,而不是一氧化碳,是二氧化碳,故A错误;
B、稀醋酸是弱酸电离过程是吸热过程,与0.1mol•L-1NaOH溶液反应放出的热量小于中和热,焓变是负值则:H+(aq)+OH-(aq)═H2O(l)△H>-57.3kJ•mol-1,
故B错误;
C、已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+571kJ.mol-1,故C错误;
D、密闭容器中,9.6g硫粉物质的量为0.3mol,与11.2g铁粉物质的量为0.2mol混合加热生成硫化亚铁17.6g时,硫过量,放出19.12kJ热量,所以1mol铁反应放热=19.12KJ×$\frac{1}{0.2}$=95.6KJ,热化学方程式为Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1 ,故D正确;
故选D.
点评 本题考查了化学反应能量变化,热化学方程式书写,燃烧热,中和热放热概念分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
1.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}{{O}_2}({g})$△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}{{O}_2}({g})$△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为566 kJ/mol | |
| B. | 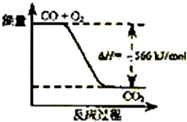 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<-452 kJ/mol | |
| D. | CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为4NA |
2. 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )| A. | 该硫酸的物质的量浓度为18.4 mol/L | |
| B. | 1 mol Zn与足量的该硫酸反应,产生22.4 L氢气 | |
| C. | 配制20 mL 4.6 mol/L的稀硫酸需用量筒取该硫酸5.00 mL | |
| D. | 该硫酸与等体积的水混合后所得溶液的物质的量浓度等于9.2 mol/L |
19.如表实验不能达到预期目的是( )
| 序号 | 实验操作 | 实验目的 |
| A | 浓、稀HNO3分别与Cu反应 | 比较浓、稀HNO3的氧化性强弱 |
| B | 验证Ksp(AgI)<Ksp(AgCl) | 向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液 |
| C | 往稀硫酸中加入少量硫酸铜 | 加快锌与稀硫酸反应的反应速率 |
| D | 检验乙酸溶液中是否混有乙醇 | 取样液于试管,加一绿豆颗粒大的钠粒 |
| A. | A | B. | B | C. | C | D. | D |
6.下列各组离子在指定环境中一定能大量共存的是( )
| A. | 在c(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 无色溶液中:Fe3+、K+、Cl-、H+ | |
| C. | 在pH=12的溶液中:SO32-、CO32-、Na+、K+ | |
| D. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、Na+ |
16.2015年10月5日,中目著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“囡为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.青蒿素是从植物黄花蒿茎叶中提取的,其结构简式如图,下列说法不正确的是( )

| A. | 该分子中有6个手性碳原子 | |
| B. | 它的分子式为C15H22O5 | |
| C. | 因其具有过氧基团,它不稳定,易受湿、热和还原性物质的影响而变质 | |
| D. | 它在常见有机溶剂中的溶解度大于在水中的溶解度 |
3.关于下列氧化还原反应的说法正确的是( )
| A. | 在2Al+2NaOH+2H2O═2NaAlO2+3H2反应中,水和氢氧化钠均作氧化剂 | |
| B. | Al分别于盐酸和氢氧化钠溶液反应,生成等质量的H2,转移的电子数相同 | |
| C. | CO2与Na2O2反应中,每生成1molO2,转移4mol电子 | |
| D. | 在Cu2S+4H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+S↓+SO2↑+4H2O反应中,被氧化的元素只有硫 |
20.在室温下的所给溶液中,下列粒子一定能够大量共存的是( )
| A. | 0.1 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | pH=1的溶液中:K+、Cr2O72-、CH3CH2OH、SO42- | |
| D. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:Ba2+、K+、Cl-、NO3- |
1.为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是( )
| 选项 | 物质 | 试剂 | 分离方法 |
| A | Cl2(水蒸气) | 生石灰 | 洗气 |
| B | KCl溶液(K2SO4) | 适量Ba(NO3)2溶液 | 过滤 |
| C | NaCl固体(KNO3) | 蒸馏水 | 冷却结晶 |
| D | 花生油(水) | - | 分液 |
| A. | A | B. | B | C. | C | D. | D |