题目内容
下列有关叙述不正确的是( )
| A、等浓度的NaCN、NaHSO3混合溶液中:c(HCN)+c(CN-)=c(HSO3-)+c(H2SO3) |
| B、pH=4.5的食醋中c(H+)是pH=6.5的番茄汁中c(H+)的100倍 |
| C、10mlpH=2的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气较多,说明HA的酸性比HB的弱 |
| D、pH=4.5的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题
分析:A.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
B.c(H+)=10-pH;
C.pH相等的不同一元酸,相同体积时生成氢气越多其浓度越大;
D.pH=4.5的CH3COOH与CH3COONa混合溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒判断C(CH3COO-)、c(Na+)相对大小.
B.c(H+)=10-pH;
C.pH相等的不同一元酸,相同体积时生成氢气越多其浓度越大;
D.pH=4.5的CH3COOH与CH3COONa混合溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒判断C(CH3COO-)、c(Na+)相对大小.
解答:
解:A.任何电解质溶液中都存在物料守恒,根据物料守恒得c(HCN)+c(CN-)=c(HSO3-)+c(SO32-)+c(H2SO3),故A错误;
B.c(H+)=10-pH,所以pH=4.5的食醋中c(H+)是pH=6.5的番茄汁中c(H+)的100倍,故B正确;
C.pH相等的不同一元酸,相同体积时生成氢气越多其浓度越大,所以HA的浓度大于HB,HA的浓度大于HB,但两种溶液中氢离子浓度相等,说明HA的电离程度小,则酸性弱,故C正确;
D.pH=4.5的CH3COOH与CH3COONa混合溶液呈酸性,则 c(H+)>c(OH-),根据电荷守恒得C(CH3COO-)>c(Na+),故D正确;
故选A.
B.c(H+)=10-pH,所以pH=4.5的食醋中c(H+)是pH=6.5的番茄汁中c(H+)的100倍,故B正确;
C.pH相等的不同一元酸,相同体积时生成氢气越多其浓度越大,所以HA的浓度大于HB,HA的浓度大于HB,但两种溶液中氢离子浓度相等,说明HA的电离程度小,则酸性弱,故C正确;
D.pH=4.5的CH3COOH与CH3COONa混合溶液呈酸性,则 c(H+)>c(OH-),根据电荷守恒得C(CH3COO-)>c(Na+),故D正确;
故选A.
点评:本题考查离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,利用物料守恒、电荷守恒解答即可,注意B中氢离子浓度与pH之间的换算,为易错点.

练习册系列答案
相关题目
下列物质:①H3O+ ②[B(OH)4]- ③CH3COO ④NH3 ⑤CH4⑥NH4+中存在配位键的是( )
| A、①②⑥ | B、①③⑤ |
| C、③④⑤ | D、②④⑥ |
依托孕烯是一种激素类药物,结构如图所示.下列有关依托孕烯的说法正确的是( )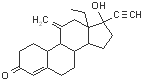

| A、依托孕烯的分子式为C21H28O2 |
| B、依托孕烯能与FeCl3溶液发生显色反应 |
| C、l mol依托孕烯最多能与5mol氢气发生加成反应 |
| D、依托孕烯能发生氧化、加成、消去、酯化等反应 |
实验室中需要配制2mol?L-1的NaCl溶液980mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
| A、950 mL 111.2 g |
| B、500 mL 117.0g |
| C、1000 mL 117.0 g |
| D、1000 mL 114.7 g |
下列有关说法正确的是( )
| A、植物油可与氢气发生加成反应转变为脂肪 |
B、含1 mol 该羟基酸的溶液可与含3 mol氢氧化钠的溶液恰好完全反应 该羟基酸的溶液可与含3 mol氢氧化钠的溶液恰好完全反应 |
| C、CH3-CO18OH和CH3CH2-OH发生酯化反应得到的乙酸乙酯的相对分子质量为90 |
| D、油脂、聚乙烯、淀粉、纤维素、蛋白质都是混合物 |
 写出下列反应的热化学方程式.
写出下列反应的热化学方程式.