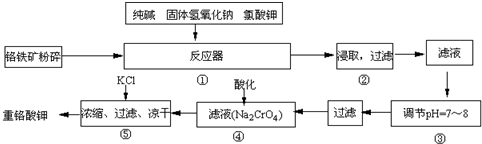
题目内容
14.某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞. ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成淡黄色沉淀 |
(1)实验目的:证明同周期元素金属性,非金属性递变规律.
(2)实验用品:仪器、材料:略 药品:略
(3)实验内容:用序号填写下表中的实验方案,并完成相关的离子方程式
| 实验方案 | 实验现象 | 有关离子方程式 |
| A | ||
| B | 不填 | |
| C | 不填 | |
| D | 不填 | |
| E |
(5)请用原子结构理论解释上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
分析 (1)实验目的为证明同周期元素性质递变规律;
(3)A为钠与水反应;E为硫化氢与氯气反应;
(4)根据实验现象比较金属性、非金属性的强弱;
(5)从原子核内质子对核外电子的吸引能力分析.
解答 解:(1)Na、Mg、Al为同周期金属元素,S、Cl为同周期非金属元素,则由题目可知,实验目的为同周期元素性质递变规律,
故答案为:证明同周期元素金属性,非金属性递变规律;
(3)A为钠与水反应,其反应离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;E为硫化氢与氯气反应,其反应的离子方程式为:H2S+Cl2=2H++2Cl-+S↓;
故答案为:2Na+2H2O=2Na++2OH-+H2↑;H2S+Cl2=2H++2Cl-+S↓;
(4)元素的金属性越强,对应的金属单质越活泼,越易与水或酸反应,反应越剧烈,所以由实验现象可知金属性Na>Mg>Al,可利用非金属单质之间的置换反应比较元素的非金属性强弱,S2-+Cl2=2Cl-+S↓,则非金属性Cl>S,则同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强;
故答案为:同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强;
(5)从原子结构的角度分析,原子的原子半径越小,原子核对核外电子的吸引能力越强,原子的吸电子能力越强,失去电子能力越弱,核内质子数越多,核外电子的吸引能力越强,原子的吸电子能力越强,失去电子能力越弱,
故答案为:同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
点评 本题考查同周期元素性质递变规律,题目难度中等,注意物质的性质以及元素周期律的递变规律,侧重于考查学生的分析能力和实验探究能力.

练习册系列答案
相关题目
4.用铁片与2mol/L稀硫酸反应制取氢气时,下列措施不能使氢气生成速率减小的是( )
| A. | 加少量CH3COONa固体 | B. | 加水 | ||
| C. | 加少量CuSO4固体 | D. | 加等量等浓度Na2SO4溶液 |
5.某同学设计在KOH溶液中用铂作电极,利用CH3OH和O2的反应来构成原电池.下列说法正确的是①正极上O2得到电子,发生还原反应②每消耗1 mol CH3OH可以向外电路提供6 mol e-③该电池的总反应为2CH3OH+3O2═2CO2+4H2O④电池放电后,溶液的pH不断升高( )
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
2.下列说法错误的是( )
| A. | 化学反应实质是旧键断裂新键形成,化学反应中的能量变化本质原因就是旧键断裂所吸收的能量和新键形成所释放的能量不同 | |
| B. | 极性键就是共用电子对发生偏移的共价键 | |
| C. | 氢键是一种比较弱的化学键 | |
| D. | 水结冰时体积膨胀、密度减小就是因为氢键的存在 |
19.将Mg和Cu组成的混合物7.64g投入足量的稀硝酸中使其完全反应,得到的唯一还原产物NO在标准状况下体积为2.24L.将反应后的溶液稀释为1L,测得溶液的pH=1,此时溶液中NO3-的浓度为( )
| A. | 0.3 mol/L | B. | 0.4 mol/L | C. | 0.5 mol/L | D. | 0.6 mol/L |
6.NA表阿伏加德罗常数,下列叙述正确的是( )
| A. | 1 mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 电解Na2SO4饱和溶液,若生成2 NA个H2,一定生成NA个O2 | |
| C. | 常温常压下,46 g NO2的原子数为3NA | |
| D. | 1 mol NO,与H2O完全反应时转移的电子数为2NA |
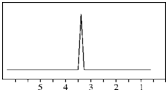 (1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)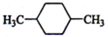 B、
B、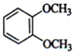 C、
C、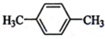 D、CH3CH2CH2CH3
D、CH3CH2CH2CH3