题目内容
4.用铁片与2mol/L稀硫酸反应制取氢气时,下列措施不能使氢气生成速率减小的是( )| A. | 加少量CH3COONa固体 | B. | 加水 | ||
| C. | 加少量CuSO4固体 | D. | 加等量等浓度Na2SO4溶液 |
分析 减小反应速率可减小浓度、降低温度或减小固体的表面积,原电池反应增大反应速率,以此解答.
解答 解:A.加少量CH3COONa固体,生成醋酸,氢离子浓度降低,反应速率减小,故A不选;
B.加水,浓度降低,反应速率减小,故B不选;
C.加少量CuSO4固体,铁置换出铜,形成原电池反应,加快反应速率,故C选;
D.加等量等浓度Na2SO4溶液,溶液体积增大,浓度减小,反应速率减小,故D不选.
故选C.
点评 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力的考查,注意原电池发反应的特点,为易错点,题目难度不大.

练习册系列答案
相关题目
1.由我国已故著名化学实业家吴蕴初先生创办的上海天原化工厂,目前生产的液氯中含Cl299.9%,含水量小于0.05%,该化工厂生产的液氯应该是( )
| A. | 纯净物 | B. | 混合物 | C. | 化合物 | D. | 单质 |
2.中国科学家利用干冰和金属钠在不锈钢反应釜中反应合成出微米级金刚石,其反应为CO2(s)+Na$\stackrel{440℃}{→}$金刚石+石墨+Na2CO3.下列说法正确的是( )
| A. | Na2CO3的摩尔质量为106 g | |
| B. | 金刚石与石墨互为同位素 | |
| C. | 常温下,4.6gNa中含有的质子数为2.2NA | |
| D. | 标准状况下,11.2LCO2完全参与反应,转移的电子数为2NA |
12.下列有关能量变化的说法正确的是( )
| A. | 2SO2(g)+O2(g)$?_{500℃}^{V_{2}O_{5}}$2SO3(g)△H=-196.6kJ/mol,若2molSO2完全反应则放出热量等于196.6kJ | |
| B. | “冰,水为之,而寒于水”说明相同质量的水和冰比较,冰的能量高 | |
| C. | 已知C(石墨)=C(金刚石)△H=+1.9kJ/mol,则从能量角度看金刚石比石墨稳定 | |
| D. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
19.在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 在相同条件下,甲酸的导电性比强酸溶液的导电性弱 | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
9.下列各种冶炼方法中,可制得相应金属的为( )
| A. | 加热氧化镁 | B. | 电解熔融氧化铝 | ||
| C. | 电解氯化钠溶液 | D. | 氯化钠与铝粉高温共热 |
16.某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积),关于该固体混合物,下列说法正确的是( )
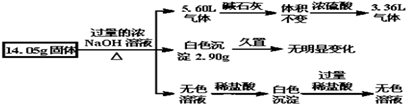

| A. | 一定含有Al,其物质的量为$\frac{5}{3}$mol | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 一定含有(NH4)2SO4和FeCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
14.某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
请你帮助该同学整理并完成实验报告
(1)实验目的:证明同周期元素金属性,非金属性递变规律.
(2)实验用品:仪器、材料:略 药品:略
(3)实验内容:用序号填写下表中的实验方案,并完成相关的离子方程式
(4)实验结论:同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强.
(5)请用原子结构理论解释上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞. ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成淡黄色沉淀 |
(1)实验目的:证明同周期元素金属性,非金属性递变规律.
(2)实验用品:仪器、材料:略 药品:略
(3)实验内容:用序号填写下表中的实验方案,并完成相关的离子方程式
| 实验方案 | 实验现象 | 有关离子方程式 |
| A | ||
| B | 不填 | |
| C | 不填 | |
| D | 不填 | |
| E |
(5)请用原子结构理论解释上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
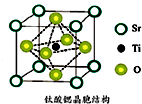 氢能被视作连接化石能源和可再生能源的重要桥梁.
氢能被视作连接化石能源和可再生能源的重要桥梁.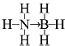 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).