题目内容
9.某混合溶液中所含离子的浓度如下表,则M离子可能为( )| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol•L-1) | 2 | 1 | 2 | 1 |
| A. | Mg2+ | B. | Ba2+ | C. | F- | D. | Fe2+ |
分析 根据溶液不显电性,阳离子带的电荷总数等于阴离子带的电荷总数来判断离子的电荷,并利用离子之间的反应来判断存在的离子.
解答 解:因溶液不显电性,设M离子的电荷为x,由电荷守恒可知,
2×1+1×2=1×2+x×1,
解得x=+2,
由于Ba2+与SO42-反应生成沉淀,NO3-与Fe2+反应发生氧化还原反应,则只有Mg2+符合,
故选A.
点评 本题考查溶液为电中性和离子共存,为高频考点,侧重于学生的分析能力的考查,明确溶液中阴阳离子的电荷总数相等即可解答,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.在甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 在相同条件下,甲酸的导电性比强酸溶液的导电性弱 | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
20.下列溶液中各微粒的浓度关系正确的是( )
| A. | c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl三种溶液的物质的量浓度关系为c(NH4HSO4)>c(NH4HCO3)>c(NH4Cl) | |
| B. | 将10mL0.1mol•L-1Na2CO3溶液逐滴滴加到10mL0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| C. | 室温下,向100mL0.1mol/LNaOH溶液中滴加0.1mol/LNH4HSO4溶液至溶液呈中性,溶液中各离子浓度大小关系:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) | |
| D. | 0.2mol•L-1的某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)═2c(H+)+c(HA) |
17.工业上废气中的氮氧化合物是主要的大气污染物之一,为了保护环境,工业上常通入氨气后发生如下反应:NOx+NH3→N2+H2O,使之转化为无毒的氮气,现有NO2和NO的混合气体3L,同温同压下通入NH3 3L,恰好使其完全转化为N2,则原混合气体中的NO2和NO的物质的量之比为( )
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 1:4 |
4.丁烷催化裂化时,碳链按两种方法断裂,生成两种烷烃和两种烯烃.如果丁烷的分解率为90%,且裂化生成的两种烯烃的物质的量相等,那么裂化所得气体中密度最小的气体在混合气体中占的体积百分含量约为( )
| A. | 24% | B. | 30% | C. | 40% | D. | 19% |
14.某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
请你帮助该同学整理并完成实验报告
(1)实验目的:证明同周期元素金属性,非金属性递变规律.
(2)实验用品:仪器、材料:略 药品:略
(3)实验内容:用序号填写下表中的实验方案,并完成相关的离子方程式
(4)实验结论:同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强.
(5)请用原子结构理论解释上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
| 实验方案 | 实验现象 |
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞. ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成淡黄色沉淀 |
(1)实验目的:证明同周期元素金属性,非金属性递变规律.
(2)实验用品:仪器、材料:略 药品:略
(3)实验内容:用序号填写下表中的实验方案,并完成相关的离子方程式
| 实验方案 | 实验现象 | 有关离子方程式 |
| A | ||
| B | 不填 | |
| C | 不填 | |
| D | 不填 | |
| E |
(5)请用原子结构理论解释上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
1.在如图装置中,若通电一段时间后乙装置左侧电极质量增加,则下列说法错误的是( )
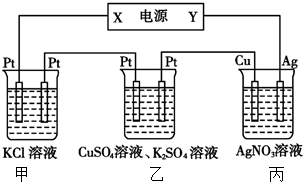

| A. | 当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g | |
| B. | 电解过程中装置丙的pH无变化 | |
| C. | 向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 | |
| D. | 乙中左侧电极反应式:Cu2++2e-=Cu |