题目内容
20.9gH2O的物质的量是0.5mol,28g CO所含的电子数为NA.分析 根据n=$\frac{m}{M}$计算出9g水、28gCO的物质的量;CO分子中含有14个电子,根据N=nNA计算出含有的电子数,据此进行解答.
解答 解:9gH2O的物质的量为:$\frac{9g}{18g/mol}$=0.5mol;
28g CO的物质的量为:$\frac{28g}{28g/mol}$=1mol,1molCO分子中含有的电子数为NA,
故答案为:0.5mol;NA.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的分析能力及化学计算能力.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
10.下列说法正确的是( )
| A. | 只含一种分子的物质是纯净物,只含一种元素的物质也是纯净物 | |
| B. | 医疗上的血液透析利用了胶体的性质 | |
| C. | NH3溶于水后所得的溶液可以导电,所以NH3为电解质 | |
| D. | 从海水中可以得到NaCl,电解NaCl溶液可制备Na |
11.下列实验操作或结论正确的是( )
| A. | 配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水 | |
| B. | 实验室里需要480 mL 2.0 mol/L的氢氧化钠溶液,配制该溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、定容、摇匀的步骤进行操作 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液的浓度偏大 | |
| D. | 实验室配制500 mL 0.2 mol/L的硫酸亚铁溶液,其操作是用天平称量27.8 g绿矾,将其放入500 mL容量瓶,加水溶解、稀释、定容、摇匀 |
8.下列各种说法中,正确的是( )
| A. | 某化合物电离时,生成的阳离子有氢离子的一定是酸 | |
| B. | 某化合物电离时,生成的阴离子有氢氧根离子的一定是碱 | |
| C. | 某化合物电离时,只生成了金属阳离子和酸根离子的一定是盐 | |
| D. | NH4Cl是一种盐,电离的电离方程式是:NH4Cl=NH4++Cl- |
15.下列叙述正确的是( )
| A. | 所有的物质中都含有化学键 | |
| B. | 含有非极性键的化合物不一定是共价化合物 | |
| C. | 反应物总能量低于生成物总能量的反应一定是吸热反应 | |
| D. | 由非金属元素构成的化合物一定是共价化合物 |
5.有机物M是合成某药品的中间体,结构简式如图所示.下列说法错误的是( )
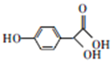

| A. | 用钠可检验M分子中存在羟基 | B. | M能发生酯化、加成、氧化反应 | ||
| C. | M的分子式为C8H8O4 | D. | M的苯环上一硝基代物有2种 |
12.不用任何试剂鉴别硫酸、硫酸钠、碳酸钠、氯化钡四种无色溶液,将它们两两混合现象如下:
由表可知:
( 1)B为BaCl2;C为Na2SO4(填化学式)
(2)要确定A、D还要进行的实验操作是:在A、D溶液中分别加入稀盐酸,若有生成气体现象,证明是Na2CO3(填化学式)
(3)写出A和D反应的离子方程式:CO32-+2H+=CO2↑+H2O.
| A | B | C | D | |
| A | -- | 白色沉淀 | 无现象 | 无色气体 |
| B | 白色沉淀 | -- | 白色沉淀 | 白色沉淀 |
| C | 无现象 | 白色沉淀 | -- | 无现象 |
| D | 无色气体 | 白色沉淀 | 无现象 | -- |
( 1)B为BaCl2;C为Na2SO4(填化学式)
(2)要确定A、D还要进行的实验操作是:在A、D溶液中分别加入稀盐酸,若有生成气体现象,证明是Na2CO3(填化学式)
(3)写出A和D反应的离子方程式:CO32-+2H+=CO2↑+H2O.
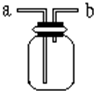 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.