题目内容
8.煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境.采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率.相关反应的热化学方程式如下:CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)?CaS(s)+4CO2(g)△H2=-175.6kJ•mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能够自发进行的条件是高温.
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅱ的Kp=$\frac{{P}^{4}(C{O}_{2})}{{P}^{4}(CO)}$(用表达式表示).
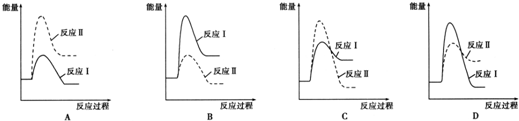
(3)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是C.
(4)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是如果气体中SO2和CO2浓度之比随时间变化,则两个反应同时进行.
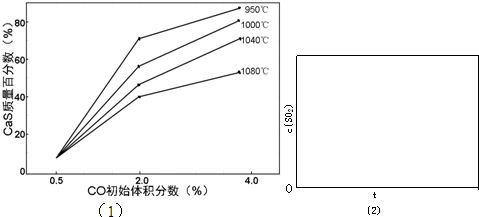
(5)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线.则降低该反应体系中SO2生成量的措施有ABC.
A.向该反应体系中投入石灰石 B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数 D.提高反应体系的温度
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)随时间t变化的总趋势图.
分析 (1)反应能自发进行,应满足△H-T•△S<0;
(2)表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量的浓度c(B),可根据平衡常数的表达式书写,平衡常数等于气体生成物浓度幂之积除以气体反应物浓度幂之积;
(3)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,结合反应物与生成物总能量大小之间的关系判断;
(4)反应Ⅰ生成SO2和CO2,反应Ⅱ只生成CO2,如同时发生,则两种气体的浓度比会随时间发生变化;
(5)由反应Ⅰ可知生成二氧化硫的反应为吸热反应,则低温下不利于生成二氧化硫;
(6)反应Ⅰ和Ⅱ同时发生,且v1>v2,因反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则温度逐渐降低,反应速率逐渐减小.
解答 解:(1)反应Ⅰ吸热,则△H>0,由方程式可知△>0,反应能自发进行,应满足△H-T•△S<0,则应在较高温度下进行,故答案为:高温;
(2)由题意可知,反应Ⅱ的Kp=$\frac{{P}^{4}(C{O}_{2})}{{P}^{4}(CO)}$,故答案为:$\frac{{P}^{4}(C{O}_{2})}{{P}^{4}(CO)}$;
(3)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则A、D错误;反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则反应Ⅱ的活化能较大,则B错误、C正确,
故答案为:C;
(4)反应Ⅰ生成SO2和CO2,反应Ⅱ只生成CO2,如同时发生,则两种气体的浓度比随时间会发生变化,
故答案为:如果气体中SO2和CO2浓度之比随时间变化,则两个反应同时进行;
(5)A.向该反应体系中投入石灰石,可使更多的二氧化硫转化为硫酸钙,减少二氧化硫的排放,故A正确;
B.由反应Ⅰ可知生成二氧化硫的反应为吸热反应,则低温下不利于生成二氧化硫,则应在合适的温度区间内控制较低的反应温度,故B正确;
C.由图象可知,提高CO的初始体积百分数,增大CaS的质量分数,减少二氧化硫的排放,故C正确;
D.提高反应体系的温度,不利于二氧化硫的减少,故D错误.
故答案为:ABC;
(6)反应Ⅰ和Ⅱ同时发生,且v1>v2,所以刚开始生成二氧化硫速率快,随着反应2进行,生成二氧化碳越来越多,促使第一个反应平衡向左移动,导致二氧化硫的量降低,直到达到平衡不变.
则图象应为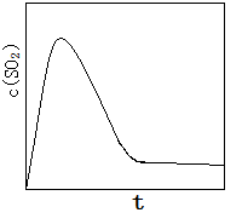 ,故答案为:
,故答案为: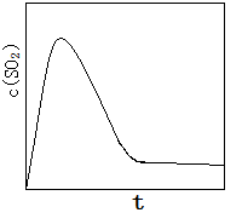 .
.
点评 本题为2014浙江高考题,涉及化学平衡以及反应热与焓变的考查,侧重于学生的分析能力和计算能力的考查,题目较为综合,涉及面广,题目难度较大.

 53随堂测系列答案
53随堂测系列答案| A. | 含MnO2的分散系中,K+、H2O2、S、Br--可以大量共存 | |
| B. | MnO2和浓盐酸反应的离子方程式:4HCl+MnO2═2Cl-+Cl2↑+Mn2++2H2O | |
| C. | MnO2在高锰酸钾的分解反应中是氧化产物 | |
| D. | 1 mol MnO2和参与反应:3MnO2+4Al═3Mn+2Al2O3,转移4 mol电子 |
| A. | 2molFe2+被氧化时有1molO2被还原 | B. | 该反应中只有Fe2+是还原剂 | ||
| C. | 每生成1molFe3O4转移2mol电子 | D. | 反应方程式中化学计量数x=2 |
| A. | 电离程度 | B. | 酸的物质的量浓度 | ||
| C. | 与Zn反应开始时的反应速率 | D. | 与足量的Zn反应产生H2量 |
| A. | Mg17Al12是离子化合物 | |
| B. | 为防止金属氧化,熔炼制备Mg17Al12时通氮气做保护气 | |
| C. | 732 g的合金能吸收380.8 L氢气 | |
| D. | 该合金的熔点比镁和铝的熔点低 |
| A. | K+、Ba2+、NO3-、CO32- | B. | Cu2+、K+、NO3-、SO42- | ||
| C. | Na+、K+、Cl-、SO42- | D. | Fe2+、H+、Cl-、NO3- |
 硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:
硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下: