题目内容
20.下列指定的比值为2:1的是( )| A. | 0.2 mol/L 和0.1 mol/L的氨水中c(OH-)之比 | |
| B. | H2S溶液中c(H+)与c(S2-)之比 | |
| C. | Na2S溶液中c(Na+)与c(S2-)之比 | |
| D. | Na2O2晶体中阳离子与阴离子个数之比 |
分析 A.弱电解质溶液中,弱电解质的浓度越大,其电离程度越小,浓度越小,其电离程度越大;
B.第二步电离HS-?S2-+H+电离出c(H+)=c(S2-),而第一步电离程度远大于第二步电离;
C.在硫化钠中能电离出钠离子和硫离子,硫离子水解,导致硫离子浓度会减小;
D.根据Na2O2为离子化合物,既含有离子键,又含有共价键,阴、阳离子个数之比为1:2.
解答 解:A.一水合氨是弱电解质,在溶液里存在电离平衡,氨水的浓度越大,一水合氨的电离程度越小,浓度越小,一水合氨的电离程度越大,A瓶氨水的浓度是B瓶氨水的浓度的2倍,因弱电解质的浓度越小,电离程度越大,故A瓶氨水的电离度比B瓶氨水的电离度小,所以A、B两瓶氨水中[OH-]之比小于2,故A错误;
B.第二步电离HS-?S2-+H+电离出c(H+)=c(S2-),而第一步电离程度远大于第二步电离,所以溶液中c(H+)>2c(S2-),故B错误;
C.硫化钠中能电离出钠离子和硫离子,电离出的钠离子浓度应是硫离子浓度的2倍,但是硫离子一部分会水解,导致硫离子浓度会减小,所以c(Na+):c(S2-)>2:1,故C错误;
D.Na2O2为离子化合物,是由钠离子和过氧根离子构成的离子化合物,阳离子与阴离子个数之比为2:1,故D正确,
故选D.
点评 本题考查了弱电解质电离、盐类水解,明确弱电解质电离特点是解本题关键,难度中等,需要注意的是Na2O2为离子化合物,阴、阳离子个数之比为1:2.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
10.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 某密闭容器盛有0.1molN2和0.3molH2,充分反应后,形成的N-H键数目为0.6NA | |
| B. | 若由CO2和O2组成的混合物共有NA个分子,则其中所含的氧原子数为2NA | |
| C. | 常温下,1L0.1mol/LNH4NO3溶液中的氢原子数为0.4NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体(标况下)时,电路中通过的电子数目为2NA |
15.下列分子中,所有原子不可能处在同一平面上的是( )
| A. | CH4 | B. | CS2 | C. | H2O | D. | SO2 |
5.下列有关叙述正确的是( )
| A. | 煤经过分馏可得到焦炭、煤焦油和焦炉气 | |
| B. | 石油裂化是为了获得更多的汽油 | |
| C. | 医用酒精的浓度通常为95% | |
| D. | 甲烷、汽油、酒精都是可燃性烃,都可作燃料 |
12. X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):
请回答:
(1)Z2Y2的电子式为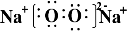 ,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、
,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、
(2)Z2Y2遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为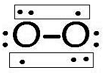 ,其分子空间构型为直线型.
,其分子空间构型为直线型.
(3)X、Y、Z、W四种元素所形成的单质中,硬度最大的是金刚石(填物质的名称);晶体ZW的熔点比晶体XW4明显高的原因是NaCl为离子晶体而CCl4为分子晶体;XW4中X原子的杂化轨道类型为sp3.
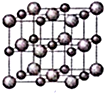
(4)ZW晶体的结构示意图如图所示.设该晶体的摩尔质量为M g/mol,晶体的密度为ρ g/cm3.阿伏伽德罗常数为NA,则晶体中两个最近的Z离子中心间的距离=$\frac{\sqrt{2}}{2}$$\root{3}{\frac{4M}{ρ{N}_{A}}}$.
 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
(1)Z2Y2的电子式为
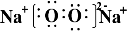 ,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、
,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、(2)Z2Y2遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为
 ,其分子空间构型为直线型.
,其分子空间构型为直线型.(3)X、Y、Z、W四种元素所形成的单质中,硬度最大的是金刚石(填物质的名称);晶体ZW的熔点比晶体XW4明显高的原因是NaCl为离子晶体而CCl4为分子晶体;XW4中X原子的杂化轨道类型为sp3.
(4)ZW晶体的结构示意图如图所示.设该晶体的摩尔质量为M g/mol,晶体的密度为ρ g/cm3.阿伏伽德罗常数为NA,则晶体中两个最近的Z离子中心间的距离=$\frac{\sqrt{2}}{2}$$\root{3}{\frac{4M}{ρ{N}_{A}}}$.
9.乙二醇是一种重要的有机化工原料,在478K利用草酸二甲酯催化加氢合成乙二醇的反应历程如下:
①CH3OOCCOOCH3(g)+2H2(g)?HOCH2COOH3(g)+CH3OH(g)△H1=a kJ/mol
②HOCH2COOCH3(g)+2H2(g)?HOCH2CH2OH(g)+CH3OH(g)△H2=b kJ/mol
③HOCH2CH2OH(g)+H2(g)?C2H5OH(g)+H2O(g)△H3=c kJ/mol
(1)写出478K时草酸二甲酯催化加氢合成乙二醇的热化学方程式:CH3OOCCOOCH3(g)+4H2(g)?HOCH2CH2OH(g)+2CH3OH(g)△H=(a+b)kJ/mol.
(2)下表是各反应在不同温度下的平衡常:
①写出反应③的平衡常数表达式K=$\frac{c({C}_{2}{H}_{5}OH)•c({H}_{2}O)}{c(HOC{H}_{2}C{H}_{2}OH)•c({H}_{2})}$,△H3<0(选填“>”、“=”或“<”).
②下列有关反应②的说法中,正确的是AB(选填号).
A.较低温度有利于反应②自发进行
B.恒容条件下,当反应混合气体的平均摩尔质量不再改变时,反应达到了平衡
C.升高温度,有利于提高乙二醇的产率
D.增加氢气的浓度,一定既能加快反应的速率,又能提高乙二醇的百分含量
(3)分析图1、图2,选择工业上合成乙二醇的最佳压强n(H2):n(草酸二甲酯)比例C(选填编号).
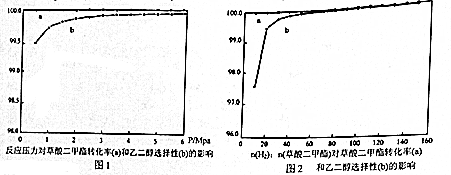
A.0~1Mpa,n(H2):n(草酸二甲酯)=40 B.1~2Mpa,n(H2):n(草酸二甲酯)=20
C.2~3Mpa,n(H2):n(草酸二甲酯)=40 D.2~3Mpa,n(H2):n(草酸二甲酯)=20
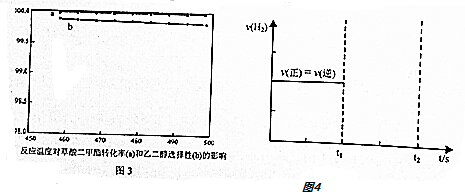
(4)图3表示温度对反应的影响,试分析工业上合成乙二醇时,实际温度不高也不低,选择在473K的理由?此反应的催化剂在473K时催化活性最好.
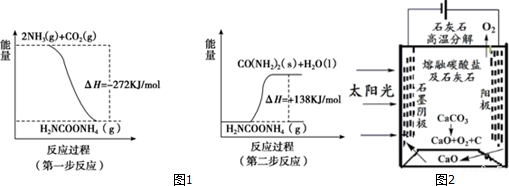
(5)对反应①,在478K、恒压条件下,充入草酸二甲酯和H2各2mol,一段时间后达平衡,若在t1时刻再充入各1mol的反应物(其它条件不变),t2时重新达到平衡,请在图4中画出正逆反应速率随时间变化的示意图.
①CH3OOCCOOCH3(g)+2H2(g)?HOCH2COOH3(g)+CH3OH(g)△H1=a kJ/mol
②HOCH2COOCH3(g)+2H2(g)?HOCH2CH2OH(g)+CH3OH(g)△H2=b kJ/mol
③HOCH2CH2OH(g)+H2(g)?C2H5OH(g)+H2O(g)△H3=c kJ/mol
(1)写出478K时草酸二甲酯催化加氢合成乙二醇的热化学方程式:CH3OOCCOOCH3(g)+4H2(g)?HOCH2CH2OH(g)+2CH3OH(g)△H=(a+b)kJ/mol.
(2)下表是各反应在不同温度下的平衡常:
| 反应/K/温度 | 458K 478K 488K |
| ① ② ③ | 1.78×104 1.43×104 1.29×104 1.91×107 1.58×107 1.45×107 8.11×108 3.12×108 2.00×108 |
②下列有关反应②的说法中,正确的是AB(选填号).
A.较低温度有利于反应②自发进行
B.恒容条件下,当反应混合气体的平均摩尔质量不再改变时,反应达到了平衡
C.升高温度,有利于提高乙二醇的产率
D.增加氢气的浓度,一定既能加快反应的速率,又能提高乙二醇的百分含量
(3)分析图1、图2,选择工业上合成乙二醇的最佳压强n(H2):n(草酸二甲酯)比例C(选填编号).

A.0~1Mpa,n(H2):n(草酸二甲酯)=40 B.1~2Mpa,n(H2):n(草酸二甲酯)=20
C.2~3Mpa,n(H2):n(草酸二甲酯)=40 D.2~3Mpa,n(H2):n(草酸二甲酯)=20
(4)图3表示温度对反应的影响,试分析工业上合成乙二醇时,实际温度不高也不低,选择在473K的理由?此反应的催化剂在473K时催化活性最好.
(5)对反应①,在478K、恒压条件下,充入草酸二甲酯和H2各2mol,一段时间后达平衡,若在t1时刻再充入各1mol的反应物(其它条件不变),t2时重新达到平衡,请在图4中画出正逆反应速率随时间变化的示意图.

 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: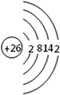 .
.