题目内容
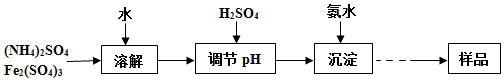
20.我国的铁矿资源储量很丰富,其中以磁铁矿(主要成分Fe3O4)和赤铁矿(主要成分是Fe2O3)两种矿石为主,某炼钢厂欲用某种矿石作炼铁原料,需要对这种矿石样品分析,探究矿石中铁的价态和测定铁元素的含量,做了一些实验.I.检验矿石样品中是否有Fe2+和Fe3+
实验操作步骤:
(1)过滤操作中用到的玻璃仪器有玻璃棒、普通漏斗、烧杯.
(2)检验有Fe2+和Fe3+常用的化学试剂有:KSCN溶液、新制氯水、KMnO4溶液、H2O2溶液.
①检验Fe3+选KSCN溶液.
②设计实验方案,证明该滤液中既有Fe2+又有Fe3+取适量滤液分别加入两支试管中,在一支试管中滴入酸性KMnO4溶液,振荡后KMnO4溶液褪色,说明有Fe2+;再在另一支试管中滴入KSCN溶液,溶液变红,说明有Fe3+.
II.测定矿石中铁元素的含量
(3)若上述实验中称取28g矿石样品,经过酸溶、过滤后得到200ml滤液,现取出20ml溶液装于锥形瓶中,先向锥形瓶中加入足量酸化的SnCl2溶液,充分反应后,再加入HgCl2除去过量的SnCl2,最后滴入20ml0.25mol/L的K2Cr2O7溶液恰好完全反应,发生的主要反应如下:2FeCl3+SnCl2=2FeCl2+SnCl4;6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,计算矿石样品中铁元素的质量分数是60%.
分析 Ⅰ.(1)依据过滤装置和操作选择需要的玻璃仪器;
(2)①检验Fe3+的试剂是硫氰酸钾溶液,遇到铁离子变化为血红色;
②证明该滤液中既有Fe2+又有Fe3+,亚铁离子检验需要利用其还原性,选择高锰酸钾溶液,铁离子检验选择KSCN溶液检验;
Ⅱ.(3)2FeCl3+SnCl2=2FeCl2+SnCl4;6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,得到6FeCl3~6FeCl2~6Fe2+~Cr2O72-,据此计算;
解答 解:I.(1)过滤操作中用到的玻璃仪器有玻璃棒、普通漏斗、烧杯,
故答案为:玻璃棒、普通漏斗、烧杯;
(2)①检验Fe3+选KSCN溶液,铁离子遇到KSCN溶液变血红色,
故答案为:KSCN溶液;
②证明该滤液中既有Fe2+又有Fe3+,亚铁离子检验需要利用其还原性,选择高锰酸钾溶液,铁离子检验选择KSCN溶液检验,步骤和现象为:取适量滤液分别加入两支试管中,在一支试管中滴入酸性KMnO4溶液,振荡后KMnO4溶液褪色,说明有Fe3+;再在另一支试管中滴入KSCN溶液,溶液变红,说明有Fe3+,
故答案为:取适量滤液分别加入两支试管中,在一支试管中滴入酸性KMnO4溶液,振荡后KMnO4溶液褪色,说明有Fe3+;再在另一支试管中滴入KSCN溶液,溶液变红,说明有Fe3+;
II.(3)2FeCl3+SnCl2=2FeCl2+SnCl4;6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
得到6FeCl3~6FeCl2~6Fe2+~Cr2O72-,
6 1
n 0.0 20L×0.25mol/L
n=0.0 20L×0.25mol/L×6=0.03mol
200ml滤液中铁元素物质的量=0.03mol×$\frac{200ml}{20ml}$=0.3mol,
矿石样品中铁元素的质量分数=$\frac{0.3mol×56g/mol}{28g}$×100%=60%,
故答案为:60%;
点评 本题考查了物质提取、物质分离和物质检验方法等知识点,掌握基础是解题关键,题目难度中等.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案| A | B | C | D | |
| 阳极 | 石墨棒 | Cu | Cu | Cu |
| 阴极 | 石墨棒 | 石墨棒 | Fe | Pt |
| 电解质 溶液 | CuSO4 溶液 | Na2SO4 溶液 | H2SO4 溶液 | CuSO4 溶液 |
| A. | A | B. | B | C. | C | D. | D |
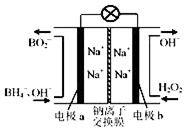 以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 每消耗3mol H2O2,转移的电子为3mol | |
| D. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
| A. | 氢氧化钠与碳酸氢钙反应 | B. | 过氧化钠与二氧化碳反应 | ||
| C. | 单质硫与氧气反应 | D. | 铁粉与氯气反应 |
①Fe(s)-2e-═Fe2+ ②H++e-═H ③4H+O2(g)═2H2O ④4Fe2++O2(g)+(4+2x)H2O═-2(Fe2O3•xH2O)(s)+8H+
根据以上过程,回答下列问题:
(1)根据以上机理,判断下列说法正确的是( )
| A. | 以上锈蚀过程是发生的化学腐蚀 | |
| B. | 从锈蚀反应的最终结果看,水既是氧化剂.又是还原剂 | |
| C. | 反应的实质是氧气被还原,金属铁被氧化 | |
| D. | 从反应机理看,锈蚀过程发生的是析氢腐蚀 |
| A. | c(Na+)>c(N3-) | B. | c(N${\;}_{3}^{-}$)>c(OH-) | ||
| C. | c(H+)>c(OH-) | D. | c(Na+)=c(N${\;}_{3}^{-}$)+c(HN3) |
(1)下列是某同学对有关物质进行分类的列表:
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | SO2 |
| 第三组 | NaOH | CH3COOH | CaF2 | Al2O3 | SO2 |
找出上述三组分类中的错误,错误物质的化学式为Al2O3.
(2)下列2个反应,按要求填写相关量.
①2Na2O2+2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成16g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是D( )填代号)
A. NaOH B.AgNO3 C.HCl D.Na2SO4.