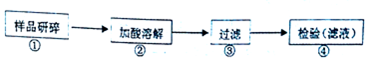
题目内容
11.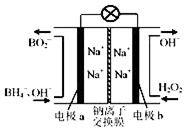 以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 每消耗3mol H2O2,转移的电子为3mol | |
| D. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
分析 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,则a为负极,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,则b为正极,结合原电池的工作原理和解答该题.
解答 解:A.正极材料采用MnO2,电极b为正极,H2O2发生还原反应,得到电子被还原生成OH-,MnO2既作电极材料又有催化作用,故A错误;
B.原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,故B错误;
C.正极电极反应式为H2O2+2e-=2OH-,每消耗3molH2O2,转移的电子为6mol,故C错误;
D.负极发生氧化反应生成BO2-,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故D正确;
故选D.
点评 本题考查原电池工作原理,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,题目难度中等.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
2.下列实验可达到实验目的是( )
| A. | 将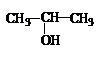 与NaOH的水溶液共热制备CH3-CH═CH2 与NaOH的水溶液共热制备CH3-CH═CH2 | |
| B. | 用甲苯与稀硝酸、稀硫酸的混合酸相混制取TNT | |
| C. | 甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 | |
| D. | 向CH3CH2Br中滴入AgNO3溶液就可以检验溴元素 |
19.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 不需加热就能发生的反应一定是放热反应 | |
| C. | 反应物总能量高于生成物总能量的反应一定是放热反应 | |
| D. | 破坏反应物中的化学键所吸收的总能量多于形成生成物中化学键所放出的总能量的反应一定是放热反应 |
6.现代居室空气污染,主要来源是化纤地毯、装饰材料、油漆家俱等释放出的主要污染物是( )
| A. | CH4 | B. | CO | C. | CO2 | D. | HCHO |
16. 一定条件下,CH4与H2O(g)发生反应CH4(g)+H2O(g)?CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示.下列说法正确的是( )
一定条件下,CH4与H2O(g)发生反应CH4(g)+H2O(g)?CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示.下列说法正确的是( )
 一定条件下,CH4与H2O(g)发生反应CH4(g)+H2O(g)?CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示.下列说法正确的是( )
一定条件下,CH4与H2O(g)发生反应CH4(g)+H2O(g)?CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示.下列说法正确的是( )| A. | 该反应的焓变△H<0 | |
| B. | 图中Z的大小为a<3<b | |
| C. | 图中X点对应的平衡混合物中$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=3 | |
| D. | 温度不变时,图中X点对应的平衡在加压后φ(CH4)减小 |
3.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是( )
| A. | 偏二甲肼的摩尔质量为60g | |
| B. | 6.02×1023个偏二甲肼分子的质量约为60g | |
| C. | 1mol偏二甲肼的质量为60g/mol | |
| D. | 6g偏二甲肼含有1.2NA个偏二甲肼分子 |
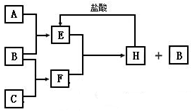 A、B、C是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):
A、B、C是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):