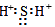题目内容
16.下列属于酸的是( )| A. | H2SO4 | B. | CO2 | C. | NaCl | D. | NaOH |
分析 电离时生成的阳离子全部是H+的化合物属于酸,据此判断.
解答 解:A.硫酸电离产生阳离子都是氢离子,属于酸,故A正确;
B.二氧化碳不能电离,属于非金属氧化物,故B错误;
C.氯化钠电离的产生钠离子和氯离子,属于盐,故C错误;
D.氢氧化钠电离产生阳离子为钠离子,阴离子为氢氧根离子,属于碱,故D错误;
故选:A.
点评 本题考查了物质类别判断,熟悉酸、碱、盐的基本概念是解题关键,题目难度不大.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 合成纤维和光导纤维都是新型无机非金属材料 | |
| B. | 明矾净水原理是吸附,不涉及化学变化 | |
| C. | SO2与FeSO4溶液使酸性高锰酸钾的紫色褪去原理相同 | |
| D. | 坩埚主要用于给固体加热,可用坩埚将烧碱加热融化 |
4.下列有关浓硫酸性质及用途的说法不正确的是( )
| A. | 具有脱水性 | B. | 溶于水放出热量 | ||
| C. | 可用于干燥氨气 | D. | 常温下铁、铝在其中钝化 |
1.向密闭容器中充入1.0mol CO和2.0mol H2O(g)发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).当反应达平衡时,CO的体积分数为α.若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达平衡时CO的体积分数小于α的是( )
| A. | 0.5 mol CO+2.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2 | |
| B. | 1.0 mol CO+2.0 mol H2O(g)+0.5 mol He | |
| C. | 1.0 mol CO+1.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2 | |
| D. | 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 |
8.用 NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在 lmol/L 的 AlCl3溶液中,A13+的个数小于NA | |
| B. | 1 mol 碳烯(:CH2)中含有电子数为8NA | |
| C. | 标准状况下,lL 己烷的分子数为$\frac{{N}_{A}}{22.4}$ | |
| D. | 1 mol C4Hl0分子中含有的共价键数无法确定 |
4.在下列各说法中,正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| C. | 1 mol H2SO4与1 mol Ba(OH)2反应放出的热叫做中和热 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的标准燃烧热 |
无机化合物可根据其组成和性质进行分类:
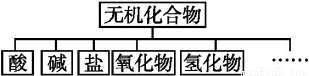
(1)上述所示物质分类方法的名称是 。
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面。(各空填写一个化学式即可)
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ② | ③ ④Ba(OH)2 | ⑤Na2CO3 ⑥ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O |
(3)写出⑦转化为⑤的化学方程式: 。
(4)写出①与③反应的离子方程式: 。
(5)写出②与⑤反应的离子方程式: 。
(6)书写下列反应的离子方程式
①Fe与CuSO4溶液反应:_________________________;
②CaCO3和稀盐酸溶液:__________________________;
 N
N