题目内容
14.下列离子反应方程式中,错误的是( )| A. | 将氨通入盐酸中:NH3+H+═NH4+ | |
| B. | 在NaOH溶液中滴入几滴NH4CI溶液并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将少量铜粉放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
分析 A.反应生成氯化铵;
B.反应生成氨气、氯化钠和水;
C.反应生成硝酸铜、二氧化氮和水;
D.Cu与稀硫酸不反应.
解答 解:A.氨通入盐酸中的离子反应为NH3+H+═NH4+,故A正确;
B.NaOH溶液中滴入几滴NH4CI溶液并加热的离子反应为NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故B正确;
C.少量铜粉放入浓硝酸中的离子反应为Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,遵循电子、电荷守恒,故C正确;
D.Cu与稀硫酸不反应,不能写离子反应方程式,故D错误;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握物质的性质、发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
4.下列判断错误的是( )
| A. | 稳定性:NH3>PH3>AsH3 | B. | 离子半径:Li+>O2->F- | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:LiOH<NaOH<KOH |
5.下列物质中,不能使有色布条褪色的是( )
| A. | 次氯酸钠溶液 | B. | 次氯酸钙溶液 | C. | 氯水 | D. | 氯化钙 |
9.为说明氯比硫的非金属性强,下列事实可作依据的是( )
| A. | HCl 的溶解性强于 H2S | B. | 氯的最高价为+7 价 | ||
| C. | H2S 中的 S2-能被 Cl2氧化 | D. | HCl O 的氧化性强于 H2SO4 |
19.下列反应的离子方程式不正确的是( )
| A. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu | |
| B. | 氢氧化钠与盐酸反应:OH-+H+═H2O | |
| C. | 氢氧化钡与硫酸反应:Ba2++SO42+═BaSO4↓ | |
| D. | 铁与稀盐酸反应:Fe+2H+═Fe2++H2↑ |
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 质量a g的C2H4和C3H6的混合物中共用电子对数目为$\frac{3a{N}_{A}}{14}$ | |
| B. | 常温下,0.1 mol•L-1的NaOH溶液中含有OH一的数目为0.1NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA | |
| D. | 7.8g过氧化钠固体中阴、阳离子总数为0.4NA |
3.化学与社会、生活密切相关,下列说法正确的是( )
| A. | 凡含有食品添加剂的食物对人体健康均有害,不可食用 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物氧化变质 | |
| C. | Fe2O3俗称铁红,常做红色油漆和涂料 | |
| D. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |
15.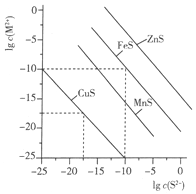 一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )
一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )
 一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )
一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )| A. | 该温度下,Ksp(MnS)大于1.0×10-35 | |
| B. | 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀 | |
| C. | 向c(Fe2+)=0.1mol•L-1的溶液中加入CuS粉末,有FeS沉淀析出 | |
| D. | 该温度下,溶解度:CuS>MnS>FeS>ZnS |
