题目内容
9.为说明氯比硫的非金属性强,下列事实可作依据的是( )| A. | HCl 的溶解性强于 H2S | B. | 氯的最高价为+7 价 | ||
| C. | H2S 中的 S2-能被 Cl2氧化 | D. | HCl O 的氧化性强于 H2SO4 |
分析 比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断.
解答 解:A.不能根据氢化物的溶解性判断非金属性的强弱,故A错误;
B.不能根据元素的化合价判断非金属性的强弱,故B错误;
C.元素的非金属性越强,对应的单质的氧化性越强,H2S 中的 S2-能被 Cl2氧化,说明非金属性Cl>S,故C正确;
D.比较非金属性的强弱,根据最高价含氧酸的酸性强弱来比较,最高价含氧酸的酸性越强,则元素的非金属性越强,不是比较氧化性,并且HClO也不是最高价含氧酸,故D错误;
故选C.
点评 本题考查非金属性的判断,题目难度不大,注意非金属性的递变规律以及比较非金属性的角度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19. 氟的单质及其化合物在工农业生产中应用非常广泛.回答下列问题:
氟的单质及其化合物在工农业生产中应用非常广泛.回答下列问题:
(1)基态氟原子的外围电子排布式为2s22p5,元素周期表中氟元素所在的区为p.
(2)电解NaHF2(氟化氢钠)可制氟气.NaHF2中所含作用力的类型有离子键、共价键、氢键,与HF2-互为等电子体的分子是CO2(或Na2O)(任写一种).
(3)OF2是一种氧化性极强的气体,其中氧原子的杂化轨道类型是sp3.
(4)部分氟化物的熔点和莫氏硬度的数据如表:
①NaF的熔点高于SiF4的原因是NaF为离子晶体,SiF4为分子晶体,由于离子键比分子间作用力强得多,故NaF的熔点高于SiF4
②MgF2的莫氏硬度大于NaF的原因是MgF2和NaF都是离子晶体,它们的阴离子都是F-,而Mg2+的半径比Na+小,Mg2+所带电荷数比Na+多,则MgF2晶格能大于NaF,故MgF2的莫氏硬度大于NaF
(5)氟化钙的晶胞结构如图所示,晶胞参数a=0.555nm.
①Ca2+、F-的配位数分别为8、4.
②列式计算氟化钙晶体的密度:ρ=$\frac{4×78}{{N}_{A}•(5.55×1{0}^{-6})^{3}}$(不必计算出结果,用NA表示阿伏加德罗常数的数值)g•cm-3.
 氟的单质及其化合物在工农业生产中应用非常广泛.回答下列问题:
氟的单质及其化合物在工农业生产中应用非常广泛.回答下列问题:(1)基态氟原子的外围电子排布式为2s22p5,元素周期表中氟元素所在的区为p.
(2)电解NaHF2(氟化氢钠)可制氟气.NaHF2中所含作用力的类型有离子键、共价键、氢键,与HF2-互为等电子体的分子是CO2(或Na2O)(任写一种).
(3)OF2是一种氧化性极强的气体,其中氧原子的杂化轨道类型是sp3.
(4)部分氟化物的熔点和莫氏硬度的数据如表:
| 化合物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
| 莫氏硬度 | 3.2 | 6.0 | 无 |
②MgF2的莫氏硬度大于NaF的原因是MgF2和NaF都是离子晶体,它们的阴离子都是F-,而Mg2+的半径比Na+小,Mg2+所带电荷数比Na+多,则MgF2晶格能大于NaF,故MgF2的莫氏硬度大于NaF
(5)氟化钙的晶胞结构如图所示,晶胞参数a=0.555nm.
①Ca2+、F-的配位数分别为8、4.
②列式计算氟化钙晶体的密度:ρ=$\frac{4×78}{{N}_{A}•(5.55×1{0}^{-6})^{3}}$(不必计算出结果,用NA表示阿伏加德罗常数的数值)g•cm-3.
20.下列物质转化在给定条件下能实现的是( )
| A. | FeS2$\stackrel{煅烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{点燃}{→}$Na2O2 | |
| C. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH}{→}$Fe(OH)2$\stackrel{空气中的灼烧}{→}$Fe2O3 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe |
17.利用下列实验装置进行相应的实验,不能达到实验目的是( )
| A. |  利用图装置,可快速制取氨气 | |
| B. |  利用图装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液 | |
| C. |  利用图装置,可制取乙酸乙酯 | |
| D. |  利用图装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
4.常温下,已知KSP(AgCl)=1.8×10-10,含Ag+、H+、NO3-、Cl-的某溶液中,C(Ag+)=0.001mol/L,则该溶液中Cl-的最大浓度为( )mol/L.
| A. | 1.0×10-5 | B. | 0.001mol/L | C. | 1.8×10-7 | D. | 0.1mol/L |
14.下列离子反应方程式中,错误的是( )
| A. | 将氨通入盐酸中:NH3+H+═NH4+ | |
| B. | 在NaOH溶液中滴入几滴NH4CI溶液并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将少量铜粉放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
1.如图所示装置,有关说法错误的是( )
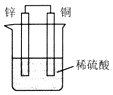

| A. | 锌是负极,其质量逐渐减少 | |
| B. | 电子由铜片经导线流向锌片 | |
| C. | H+在铜片表面被还原,产生气泡 | |
| D. | 锌片上发生氧化还原,铜片上发生还原反应 |
18.t℃时,某浓度氯化铵溶液的pH=4,下列说法中一定正确的是( )
| A. | 由水电离出的氢离子浓度为10-10 mol•L-1 | |
| B. | 溶液中c(H+)•c(OH-)=1×10-14 | |
| C. | 溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 溶液中c(NH3•H2O)+c(NH4+)=c(Cl-)+c(OH-) |
10.如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,下列说法错误的是( )

| A. | 该装置可将化学能转化为电能 | |
| B. | 正极反应式为:O2+4e-+4H+═H2O | |
| C. | 每消耗 0.2 mol CH2=CH2,则溶液中有 0.4 mol e-迁移 | |
| D. | 放电一段时间后磷酸的物质的量不变 |