题目内容
20.水是我们最常见的一种溶剂.关于下列几种“水”溶液说法中正确的是( )| A. | 双氧水被称为绿色氧化剂,是因为其还原产物通常为O2,对环境没有污染 | |
| B. | 王水是浓硫酸和浓硝酸按体积比3:1配成的混合物,可以溶解Au、Pt | |
| C. | 氨水显弱碱性,浓度越大密度越大 | |
| D. | 新制备的氯水中存在三种分子,四种离子 |
分析 A.双氧水被称为绿色氧化剂,被还原生成水;
B.水是浓盐酸和浓硝酸按体积比3:1配成的混合物;
C.氨水浓度越大,密度越小;
D.新制氯水含有氯气分子、水分子、次氯酸分子,盐酸电离、次氯酸电离、水电离.
解答 解:A.双氧水被称为“绿色氧化剂”,是因为其还原产物为水,对环境没有污染,故A错误;
B.水是浓盐酸和浓硝酸按体积比3:1配成的混合物,不是浓硫酸,故B错误;
C.氨水密度比水小,浓度越大,密度越小,故C错误;
D.新制氯水含有三种分子氯气分子、水分子,次氯酸分子;四种离子为氢离子、氢氧根离子、氯离子、次氯酸根离子,故D正确.
故选D.
点评 本题考查了氨气、氯气、过氧化氢、王水等物质的性质应用和微粒判断,为高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.在一密闭容器中有HCHO、H2、O2混合气体共20g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重8g,则原混合气体中O2的质量分数是( )
| A. | 40% | B. | 33% | C. | 60% | D. | 36% |
8.下列过程中,不涉及化学变化的是( )
| A. | 海水中获取溴和碘 | B. | 海水中提取镁 | ||
| C. | 用汽油除去衣服上的油渍 | D. | 用少量食醋除去水壶中的水垢 |
15.ClO2是一种安全、高效、强力杀菌剂,其性质如表:
回答下列问题:
(1)由表可以看出:保存液态ClO2的条件是密封、低温避光;
(2)工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制取ClO2.某研究小组设计如图1所示实验装置(略去部分装置)制备ClO2.

①在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,加热.反应后产物中有ClO2、CO2和一种酸式盐,该酸式盐的化学式为KHSO4.氧化剂与还原剂的物质的量之比为2:1.
②该实验采取的加热方式是水浴加热,图示装置中除酒精灯、烧杯外,还缺少的一种必须的玻璃仪器是温度计.
③A装置用于吸收产生的二氧化氯,其中最好盛放b.(填标号)
a.60℃的温水 b.冰水 c.饱和食盐水
④B装置中发生反应的离子方程式为2ClO2+2OH-=ClO3-+ClO2-+H2O.
⑤将二氧化氯溶液加入到硫化氢溶液中.设计实验证明:溶液含SO42-:取少量所得溶液于试管中,加入少量用稀硝酸酸化过的氯化钡溶液,出现白色沉淀.
(3)为测定A溶液中ClO2的含量.量取ClO2溶液10m L,稀释成100m L试样.量取10mL试样进行了如图2实验:(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①步骤Ⅰ加足量的KI晶体,摇匀,需在暗处静置30min.若不“在暗处静置30min”,立即进行步骤Ⅱ,则消耗Na2S2O3的体积将偏小.(填“偏大”、“偏小”或“无影响”)
②若恰好消耗c mol•L-1Na2S2O3溶液的体积为VmL,则原ClO2溶液的浓度为13.5cVg•L-1(用含字母的代数式表示)
| 色态 | 溶于碱 | 常温常压 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 不稳定 | 爆炸 |
(1)由表可以看出:保存液态ClO2的条件是密封、低温避光;
(2)工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制取ClO2.某研究小组设计如图1所示实验装置(略去部分装置)制备ClO2.

①在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,加热.反应后产物中有ClO2、CO2和一种酸式盐,该酸式盐的化学式为KHSO4.氧化剂与还原剂的物质的量之比为2:1.
②该实验采取的加热方式是水浴加热,图示装置中除酒精灯、烧杯外,还缺少的一种必须的玻璃仪器是温度计.
③A装置用于吸收产生的二氧化氯,其中最好盛放b.(填标号)
a.60℃的温水 b.冰水 c.饱和食盐水
④B装置中发生反应的离子方程式为2ClO2+2OH-=ClO3-+ClO2-+H2O.
⑤将二氧化氯溶液加入到硫化氢溶液中.设计实验证明:溶液含SO42-:取少量所得溶液于试管中,加入少量用稀硝酸酸化过的氯化钡溶液,出现白色沉淀.
(3)为测定A溶液中ClO2的含量.量取ClO2溶液10m L,稀释成100m L试样.量取10mL试样进行了如图2实验:(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①步骤Ⅰ加足量的KI晶体,摇匀,需在暗处静置30min.若不“在暗处静置30min”,立即进行步骤Ⅱ,则消耗Na2S2O3的体积将偏小.(填“偏大”、“偏小”或“无影响”)
②若恰好消耗c mol•L-1Na2S2O3溶液的体积为VmL,则原ClO2溶液的浓度为13.5cVg•L-1(用含字母的代数式表示)
12.下列过程需要通电才能进行的是( )
①电离 ②电镀 ③电解 ④电化学腐蚀.
①电离 ②电镀 ③电解 ④电化学腐蚀.
| A. | ①② | B. | ②③ | C. | ③ | D. | 全部 |
10.下列说法不正确的是( )
| A. | 马口铁镀锡的表面即使破损后也能起到很好的防锈作用 | |
| B. | FeCl3饱和溶液滴入到沸水中,并继续煮沸,可得到Fe(OH)3沉淀 | |
| C. | 反应AgCl+NaBr═AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水 | |
| D. | 除去某溶液中的SO42-,选择加入可溶性钡盐要比加入钙盐好 |
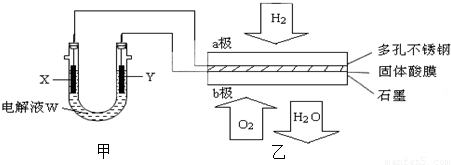
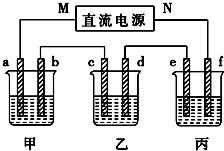 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题: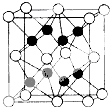 已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题:
已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题: 、
、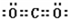 .
.