题目内容
9. 已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题:
已知:A、D、E、G、J、L、M七种元素的原子序数依次增大.A在所有元素中原子半径最小;D原子核外电子有6种不同运动状态;G与E、J均相邻;A、G、J三种元素的原子序数之和为25;J2-和L+有相同的核外电子排布;M的质子数是25.请回答下列问题:(1)元素M的基态原子外围电子排布式为3d54s2;D、E、G三种元素分别形成最简单氢化物的沸点最高的是H2O(用化学式表示).
(2)由上述元素中的两种元素组成的一种阴离子与G的一种同素异形体分子互为等电子体,该阴离子的化学式为NO2-.
(3)由上述元素组成的属于非极性分子且VSEPR为直线形的微粒的电子式为
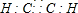 、
、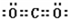 .
.(4)R是由4个E原子组成的一种不稳定的单质分子.R分子中E原子杂化方式为sp3,则R分子的空间构型为正四面体.
(5)将A2G2的溶液滴加到M的一种常见氧化物上,会产生G的一种单质,该过程的化学方程式为2H2O$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
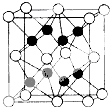
(6)上述元素中电负性最大的元素和第一电离能最小的元素形成的某化合物Q的晶胞如图所示,化合物Q与氧化钙相比,晶格能较小的是K2O(填化学式).若已知该化合物晶胞的边长为a cm,则该化合物的密度为$\frac{4×94}{NA•a3}$ g•cm-3 (只列出算式,不必算出数值,阿伏加德罗常数的值为NA).
分析 A、D、E、G、J、L、M七种元素.它们的原子序数依次增大,A在所有元素中原子半径最小,则A是H元素;
D原子核外电子有6种不同运动状态,则D为C元素;
G与E、J均相邻,A、G、J三种元素的原子序数之和为25,A的原子序数是1,所以G和J的原子序数之和为24,其平均原子序数为12,所以G原子序数小于12、J原子序数大于12,J能形成负二价阴离子,所以J为S元素,则G原子序数为8,为O元素;
E原子序数大于D而小于G,所以E是N元素;
J2-和L+有相同的核外电子排布,则L是K元素;
M的质子数是25,则M为Mn元素,由此分析解答.
解答 解:(1)则M为Mn元素,其外围电子为其最外层电子,根据构造原理知元素Mn的基态原子外围电子排布式为3d54s2;甲烷、氨气和水,水的沸点最高,故答案为:3d54s2;H2O;
(2)G为氧元素,由氧元素组成的单质有氧气和臭氧,与臭氧分子互为等电子体且属于上述元素的阴离子有NO2-,故答案为:NO2-;
(3)乙炔和二氧化碳都是直线型非极性分子,其电子式为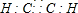 、
、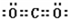 ,故答案为:
,故答案为: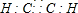 、
、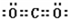 ;
;
(4)R是由4个E元素组成的一种不稳定的多原子单质分子,R分子中E原子杂化方式为sp3,则该分子为正四面体结构,其结构和白磷分子相似,故答案为:正四面体;
(5)将A2G2的溶液滴加到M的一种常见氧化物上,会产生G的一种单质,是过氧化氢在二氧化锰做催化剂的作用下分解产生氧气,方程式为:2H2O$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,故答案为:2H2O$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(6)电负性最大的元素是O元素,第一电离能最小的元素是K元素,二者生成化合物K2O,离子晶体中晶格能与电荷成正比、与离子半径成正比,钙离子电荷数大于钾离子、半径小于钾离子,所以晶格能较小的是K2O;该晶胞中白色球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球个数=8,所以黑色和白色球个数之比为2:1,其化学式为K2O,所以白色球表示氧离子、黑色球表示钾离子,晶胞的边长为a×10-10cm,晶胞体积=(a×10-10cm)3,密度ρ=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{94×4}{{N}_{A}}}{(a×1{0}^{-10})3}$g•cm-3=$\frac{\frac{94×4}{{N}_{A}}}{{a}^{3}}$g•cm-3=$\frac{4×94}{NA•a3}$g•cm-3,故答案为:K2O; $\frac{4×94}{NA•a3}$.
点评 本题考查物质结构和性质,涉及晶胞计算、晶格能、原电池原理等电子体等知识点,同时考查学生分析问题、解决问题能力,利用基本概念、基本理论解答即可,注意(4)中分子结构特点,知道4个N原子位置关系,为易错点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 双氧水被称为绿色氧化剂,是因为其还原产物通常为O2,对环境没有污染 | |
| B. | 王水是浓硫酸和浓硝酸按体积比3:1配成的混合物,可以溶解Au、Pt | |
| C. | 氨水显弱碱性,浓度越大密度越大 | |
| D. | 新制备的氯水中存在三种分子,四种离子 |
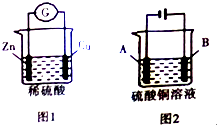
| A. | 图1装置将化学能转化为电能,电子由锌极经过稀硫酸进入铜极 | |
| B. | 利用图2装置可进行粗铜的精炼,则粗铜做A极 | |
| C. | 若A、B两电极均为铜,利用图2装置电解硫酸铜溶液,则电解后溶液的pH不变 | |
| D. | 利用图2装置可在铁上镀铜,则铁作B极 |
| A. | 正极有 O2 逸出 | |
| B. | 铜片上有 H2 逸出 | |
| C. | 电子通过导线由铜片流向锌片 | |
| D. | 正极附近的 SO42- 离子浓度逐渐增大 |
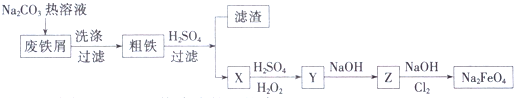
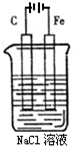 (1)如图是电解NaCl溶液的示意图.请回答下列问题:
(1)如图是电解NaCl溶液的示意图.请回答下列问题: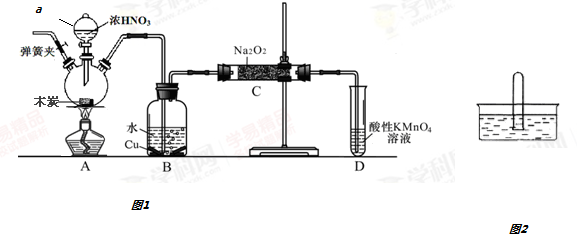
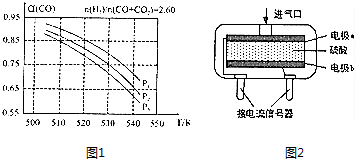 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醛,主要反应如下:
利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醛,主要反应如下: