题目内容
10.下列说法不正确的是( )| A. | 马口铁镀锡的表面即使破损后也能起到很好的防锈作用 | |
| B. | FeCl3饱和溶液滴入到沸水中,并继续煮沸,可得到Fe(OH)3沉淀 | |
| C. | 反应AgCl+NaBr═AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水 | |
| D. | 除去某溶液中的SO42-,选择加入可溶性钡盐要比加入钙盐好 |
分析 A.锡、铁做电极构成的原电池中,金属铁比锡活泼,Fe更易被腐蚀;
B.加热条件下,饱和FeCl3发生水解反应生成氢氧化铁胶体;
C.溶解度小的沉淀能够转化为溶解度更小的沉淀;
D.硫酸钙属于微溶的盐.
解答 解:A.锡、铁做电极构成的原电池中,金属铁比锡活泼,Fe作负极失电子更易被腐蚀,所以马口铁镀锡的表面即使破损后不能起到防锈作用,故A错误;
B.加热条件下,饱和FeCl3发生水解反应生成氢氧化铁胶体,所以制备氢氧化铁胶体时,可以把FeCl3饱和溶液滴入到沸水中,并继续煮沸,故B正确;
C.溶解度小的沉淀能够转化为溶解度更小的沉淀,AgBr的溶解度比AgCl小,所以反应AgCl+NaBr═AgBr+NaCl能在水溶液中进行,故C正确;
D.硫酸钙属于微溶的盐,硫酸钡属于难溶性盐,所以除去某溶液中的SO42-,选择加入可溶性钡盐要比加入钙盐好,故D正确.
故选A.
点评 本题考查了金属的腐蚀和防护、盐的水解、沉淀的转化等,题目难度不大,侧重于基础知识的考查,注意把握原电池原理.

练习册系列答案
相关题目
20.水是我们最常见的一种溶剂.关于下列几种“水”溶液说法中正确的是( )
| A. | 双氧水被称为绿色氧化剂,是因为其还原产物通常为O2,对环境没有污染 | |
| B. | 王水是浓硫酸和浓硝酸按体积比3:1配成的混合物,可以溶解Au、Pt | |
| C. | 氨水显弱碱性,浓度越大密度越大 | |
| D. | 新制备的氯水中存在三种分子,四种离子 |
15.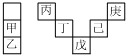 甲~庚等主族元素在周期表中的相对位置如下表,己的最高价氧化物对应的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等主族元素在周期表中的相对位置如下表,己的最高价氧化物对应的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
 甲~庚等主族元素在周期表中的相对位置如下表,己的最高价氧化物对应的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等主族元素在周期表中的相对位置如下表,己的最高价氧化物对应的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 气态氢化物的稳定性:庚<己<戊 | |
| B. | 庚与戊的原子序数相差24 | |
| C. | 庚与甲形成的单核离子半径大小为:庚<甲 | |
| D. | 丁的最高价氧化物可用于制造计算机的芯片 |
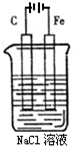 (1)如图是电解NaCl溶液的示意图.请回答下列问题:
(1)如图是电解NaCl溶液的示意图.请回答下列问题:
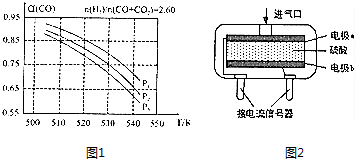 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醛,主要反应如下:
利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醛,主要反应如下:
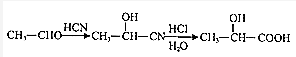
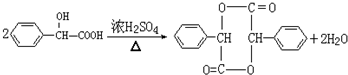 .
.