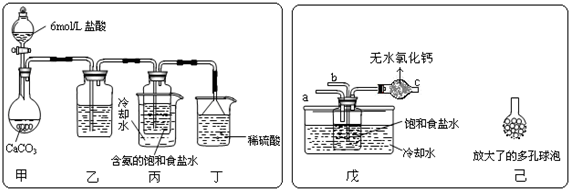
题目内容
9.容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线这五项中的( )| A. | ②④ | B. | ③⑤ | C. | ①②④ | D. | ①③⑤ |
分析 容量瓶在20℃使用,具有固定的规格,只有1个刻度线,以此来解答.
解答 解:容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、③容量、⑤刻度线,
故选D.
点评 本题考查配制溶液需要的仪器,为高频考点,把握配制溶液的仪器、使用为解答的关键,侧重分析与实验能力的考查,注意常见仪器的结构,题目难度不大.

练习册系列答案
相关题目
19.用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ•mol-1.
(2)氨气、空气可以构成燃料电池,则原电解质溶液显碱性(填“酸性”、“中性”或“碱性”),
负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(3)在0.5L的密闭容器中,一定量的N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H=akJ/mol,其化学平衡常数K与温度的关系如下:
①由上表数据可知a<0 (填“>”、“<”或“=”).
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号).
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400oC时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(4)25oC时,将amol•L-1的氨水与0.1mol•L-1的盐酸等体积混合
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,反应的情况可能为a(填字母序号).
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$.
(1)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ•mol-1.
(2)氨气、空气可以构成燃料电池,则原电解质溶液显碱性(填“酸性”、“中性”或“碱性”),
负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(3)在0.5L的密闭容器中,一定量的N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H=akJ/mol,其化学平衡常数K与温度的关系如下:
| 温度/oC | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号).
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400oC时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(4)25oC时,将amol•L-1的氨水与0.1mol•L-1的盐酸等体积混合
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,反应的情况可能为a(填字母序号).
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$.
17.下列有关化学用语表示正确的是( )
| A. | 质子数与中子数相等的硫原子:${\;}_{16}^{32}$S | |
| B. | Al3+的结构示意图: | |
| C. | CaO2的电子式: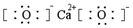 | |
| D. | 2-溴丙烷的结构简式:C3H7Br |
4.下列反应的离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓ | |
| D. | 将氢氧化铁放入盐酸中:Fe(OH)3+3H+=Fe3++3H2O |
1.下列说法正确的是( )
| A. | 高温下,可用焦炭和石英砂(SiO2)制取高纯度硅 | |
| B. | CO2和钠在一定条件下可以得到金刚石和碳酸钠,反应中氧化剂和还原剂之比是4:1 | |
| C. | 用高纯度硅作为光导纤维的主要材料 | |
| D. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl |
18.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(中括号内),溶液能与原来溶液完全一样的是( )
| A. | CuCl2[CuCl2溶液] | B. | AgNO3[Ag2O] | C. | NaCl[HCl溶液] | D. | CuSO4[CuSO4] |
19.已知如表数据:
向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |