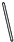题目内容
下列实验操作正确的是( )
| A、将2.5 g CuSO4?5H2O溶解在97.5 g水中配制质量分数为2.5%的CuSO4溶液 |
| B、配制1 mol/L NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶 |
| C、将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL配制100 mL 1.0 mol/L Na2SO4 |
| D、配制900 mL 2 mol/L的NaCl溶液时,选用900 mL容量瓶和称取105.3 g NaCl |
考点:配制一定物质的量浓度的溶液
专题:
分析:A.2.5 gCuSO4?5H2O中含有硫酸铜的质量小于2.5g,配制的溶液中溶质质量分数小于2.5%;
B.氢氧化钠溶液在稀释过程中会放出热量,所以配制溶液时,应该冷却后再转移氢氧化钠溶液;
C.根据溶液稀释过程中溶质的物质的量不变进行计算;
D.实验室中没有900mL的容量瓶,需要选用1000mL的容量瓶配制该溶液.
B.氢氧化钠溶液在稀释过程中会放出热量,所以配制溶液时,应该冷却后再转移氢氧化钠溶液;
C.根据溶液稀释过程中溶质的物质的量不变进行计算;
D.实验室中没有900mL的容量瓶,需要选用1000mL的容量瓶配制该溶液.
解答:
解:A.2.5 gCuSO4?5H2O中含有硫酸铜的质量为:2.5g×
=1.6g,该溶液中溶质的质量分数为:
×100%=1.6%,故A错误;
B.配制氢氧化钠溶液时,氢氧化钠在溶解过程中放出热量,必须在氢氧化钠冷却后再转移到容量瓶中,否则影响配制结果,故B错误;
C.将20mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL,稀释后的溶液的浓度为:
=1.0molL,该操作方法可以达到实验目的,故C正确;
D.配制900mL溶液,实验室中没有规格为900mL的容量瓶,需要用1000mL的容量瓶配制该溶液,配制时需要称量氯化钠的质量为:58.5g/mol×1L×2mol/L=117g,故D错误;
故选C.
| 160 |
| 250 |
| 1.6g |
| 100g |
B.配制氢氧化钠溶液时,氢氧化钠在溶解过程中放出热量,必须在氢氧化钠冷却后再转移到容量瓶中,否则影响配制结果,故B错误;
C.将20mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL,稀释后的溶液的浓度为:
| 5mol/L×0.02L |
| 0.1L |
D.配制900mL溶液,实验室中没有规格为900mL的容量瓶,需要用1000mL的容量瓶配制该溶液,配制时需要称量氯化钠的质量为:58.5g/mol×1L×2mol/L=117g,故D错误;
故选C.
点评:本题考查了配制一定物质的量浓度的溶液方法,题目难度不大,注意掌握配制一定浓度的溶液步骤,明确溶质质量分数、物质的量浓度的概念及计算方法,还需要熟悉实验室中常见容量瓶的规格.

练习册系列答案
相关题目
化学用语在化学学科中作用非常重要,以下有关化学用语描述正确的是( )
A、Mg2+的结构示意图: |
B、Na2S的电子式: |
| C、氨气的空间结构:三角形 |
| D、乙烯的结构简式:(CH2)2 |
工业上制造玻璃时不需要用到的原料是( )
| A、纯碱石 | B、石灰 | C、石英 | D、食盐 |
 如图表示反应X(g)+Y(s)?Z(s)+R(g)(△H<0)的正、逆反应速率(v)与时间(t)的关系,t1时开始改变条件,则改变的条件符合曲线的是( )
如图表示反应X(g)+Y(s)?Z(s)+R(g)(△H<0)的正、逆反应速率(v)与时间(t)的关系,t1时开始改变条件,则改变的条件符合曲线的是( )| A、减少物质Z | B、升温 |
| C、减压 | D、用催化剂 |
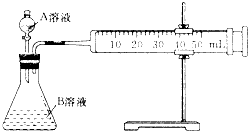
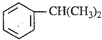 ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空: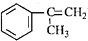 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法