题目内容
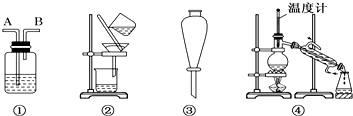
某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图象如图所示:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的离子有: .
(2)写出实验③图象中沉淀溶解阶段发生的离子反应方程式:
(3)分析图象,在原溶液中c(NH4+)与c(Al3+)的比值为 .NO3-是否存在? 填(“存在”“不存在”或“不确定”).

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的离子有:
(2)写出实验③图象中沉淀溶解阶段发生的离子反应方程式:
(3)分析图象,在原溶液中c(NH4+)与c(Al3+)的比值为
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:无色废水确定无Fe3+,根据实验①确定有Na+,根据实验②确定有SO42-,根据实验③确定有Al3+,一定不含Fe3+、Mg2+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Al3+、NH4+、H+、SO42-,根据硫酸钡沉淀求出n(SO42-),根据图象求出n(Al3+)和n(H+),再根据电荷守恒确定有没有NO3-.
解答:
解:(1)无色废水确定无Fe3+,根据实验①确定有Na+,根据实验②确定有SO42-,根据实验③确定有Al3+,一定不含Fe3+、Mg2+,因为CO32-与Al3+不能共存,所以无CO32-;故溶液中存在的离子为:Na+、Al3+、NH4+、H+、SO42-,废水中一定不存在的离子有Fe3+、Mg2+、CO32-,故答案为:Fe3+、Mg2+、CO32-;
(2)氢氧化铝能溶于氢氧化钠中,即Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)已知硫酸钡沉淀为2.33g,则n(SO42-)=
=0.01mol,
根据图象可知与Al(OH)3的OH-为:n(OH-)=0.007mol,
Al(OH)3+OH-=AlO2-+2H2O
n(Al3+) 0.007mol
所以n(Al3+)=0.007mol,将铝离子沉淀需要氢氧化钠0.021mol,所以溶液中H+消耗氢氧化钠0.014mol,氢离子的物质的量是0.014mol,
NH4++OH-=NH3?H2O,消耗氢氧化钠0.007mol,所以铵根离子的物质的量是0.007mol,原溶液中c(NH4+)与c(Al3+)的比值为1:1,
有于钠离子的量无法确定,所以根据电荷守恒,无法确定是否在存在硝酸根离子,
故答案为:1:1;不确定.
(2)氢氧化铝能溶于氢氧化钠中,即Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)已知硫酸钡沉淀为2.33g,则n(SO42-)=
| 2.33g |
| 233g/mol |
根据图象可知与Al(OH)3的OH-为:n(OH-)=0.007mol,
Al(OH)3+OH-=AlO2-+2H2O
n(Al3+) 0.007mol
所以n(Al3+)=0.007mol,将铝离子沉淀需要氢氧化钠0.021mol,所以溶液中H+消耗氢氧化钠0.014mol,氢离子的物质的量是0.014mol,
NH4++OH-=NH3?H2O,消耗氢氧化钠0.007mol,所以铵根离子的物质的量是0.007mol,原溶液中c(NH4+)与c(Al3+)的比值为1:1,
有于钠离子的量无法确定,所以根据电荷守恒,无法确定是否在存在硝酸根离子,
故答案为:1:1;不确定.
点评:本题考查了常见离子检验,现象的判断和离子检验,关键是图象分析离子特征和离子共存的判断,题目难度中等.

练习册系列答案
相关题目
有三支试管,分别加入下列物质后甲:10mL 0.01mol/L FeCl3溶液和10mL 0.01mol/L KSCN溶液乙:5mL水、10mL 0.01mol/L FeCl3溶液5mL 0.01mol/L KSCN溶液丙:10mL 0.1mol/L FeCl3溶液和10mL 0.1mol/L KSCN溶液观察这三支试管的颜色,其中颜色最浅的是( )
| A、甲试管 | B、乙试管 |
| C、丙试管 | D、无法判断 |
下列实验操作正确的是( )
| A、将2.5 g CuSO4?5H2O溶解在97.5 g水中配制质量分数为2.5%的CuSO4溶液 |
| B、配制1 mol/L NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶 |
| C、将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL配制100 mL 1.0 mol/L Na2SO4 |
| D、配制900 mL 2 mol/L的NaCl溶液时,选用900 mL容量瓶和称取105.3 g NaCl |
关于物质分类的正确组合是( )
 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO |
| C | NaOH | CH3COOH | MgCl2 | CO2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO3 |
| A、A | B、B | C、C | D、D |
石墨和金刚石都是碳的单质,1mol石墨在一定条件下可完全转化为金刚石,要吸收QKJ的能量,下列说法正确的是( )
| A、石墨不如金刚石稳定 |
| B、等质量的石墨与金刚石相比,石墨具有的能量高 |
| C、等物质的量的石墨与金刚石完全燃烧,金刚石放出的能量多 |
| D、等物质的量的石墨与金刚石完全燃烧,石墨放出的能量多 |
 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: