题目内容
为了除去括号中的杂质,选用的正确的试剂填空,并写出相应的离子反应方程式
(1)CO2(HCl) 选 ;
(2)Fe2O3(Al2O3)选 ;
(3)NaHCO3(Na2SiO3)选 ; .
(1)CO2(HCl) 选
(2)Fe2O3(Al2O3)选
(3)NaHCO3(Na2SiO3)选
考点:物质的分离、提纯的基本方法选择与应用,物质的分离、提纯和除杂
专题:
分析:(1)HCl与碳酸氢钠反应生成二氧化碳,而二氧化碳不反应;
(2)Al2O3与NaOH溶液反应,而Fe2O3不能,则加足量NaOH溶解后过滤可除杂;
(3)溶于水后通入足量二氧化碳,反应生成硅酸沉淀和碳酸氢钠,以此来解答.
(2)Al2O3与NaOH溶液反应,而Fe2O3不能,则加足量NaOH溶解后过滤可除杂;
(3)溶于水后通入足量二氧化碳,反应生成硅酸沉淀和碳酸氢钠,以此来解答.
解答:
解:(1)饱和碳酸氢钠溶液能和盐酸反应生成二氧化碳气体,实质是:HCO3-+H+=H2O+CO2↑,且碳酸氢钠和二氧化碳不反应,
故答案为:饱和NaHCO3;HCO3-+H+=H2O+CO2↑;
(2)Al2O3与NaOH溶液反应,而Fe2O3不能,则加足量NaOH溶解后过滤可除杂,则选择试剂为NaOH,发生的离子反应为Al2O3+2OH-═2AlO2-+H2O,
故答案为:NaOH溶液;Al2O3+2OH-═2AlO2-+H2O;
(3)溶于水后通入足量二氧化碳,反应生成硅酸沉淀和碳酸氢钠,然后过滤可除杂,发生的离子反应为2CO2+2H2O+SiO32-═2HCO3-+H2SiO3↓,
故答案为:足量CO2;2CO2+2H2O+SiO32-═2HCO3-+H2SiO3↓.
故答案为:饱和NaHCO3;HCO3-+H+=H2O+CO2↑;
(2)Al2O3与NaOH溶液反应,而Fe2O3不能,则加足量NaOH溶解后过滤可除杂,则选择试剂为NaOH,发生的离子反应为Al2O3+2OH-═2AlO2-+H2O,
故答案为:NaOH溶液;Al2O3+2OH-═2AlO2-+H2O;
(3)溶于水后通入足量二氧化碳,反应生成硅酸沉淀和碳酸氢钠,然后过滤可除杂,发生的离子反应为2CO2+2H2O+SiO32-═2HCO3-+H2SiO3↓,
故答案为:足量CO2;2CO2+2H2O+SiO32-═2HCO3-+H2SiO3↓.
点评:本题考查物质分离、提纯的方法及选择,为高频考点,把握物质的性质及分离方法为解答的关键,侧重除杂的考查,注意物质的性质差异及除杂原则,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
下列实验操作正确的是( )
| A、将2.5 g CuSO4?5H2O溶解在97.5 g水中配制质量分数为2.5%的CuSO4溶液 |
| B、配制1 mol/L NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶 |
| C、将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL配制100 mL 1.0 mol/L Na2SO4 |
| D、配制900 mL 2 mol/L的NaCl溶液时,选用900 mL容量瓶和称取105.3 g NaCl |
关于物质分类的正确组合是( )
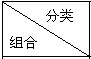 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO |
| C | NaOH | CH3COOH | MgCl2 | CO2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO3 |
| A、A | B、B | C、C | D、D |
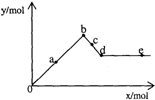 已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )| A、a-b时沉淀的物质的量:A1(OH)3比BaSO4多 |
| B、c-d时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3 |
| D、d-e时溶液中离子的物质的量:Ba2+不可能等于OH- |
 如图所示装置,检流计指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
如图所示装置,检流计指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )| A、A是Zn,B是Cu,C为稀硫酸 |
| B、A是Ag,B是Fe,C为稀AgNO3溶液 |
| C、A是Fe,B是Ag,C为稀AgNO3溶液 |
| D、A是Cu,B是Zn,C为稀硫酸 |
下列关于氯水的叙述,正确的是( )
| A、新制氯水中只含Cl2和H2O分子 |
| B、新制氯水可使蓝色石蕊试纸先变红后褪色 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后酸性会减小 |

 已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: