题目内容
下列溶液中各微粒的浓度关系一定正确的是( )
| A、某酸性溶液中只含NH4+、Cl-、H+、OH-四种离子,溶液中一定存在:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、物质的量浓度相同的4种溶液:①CH3COONa;②NaNO3;③Na2CO3;④NaOH,pH的大小顺序是:④>③>①>② |
| C、在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| D、25℃时,pH=10的CH3COONa溶液与pH=10的氨水中,由水电离出的c(OH-)之比为1:1 |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:A.溶液呈酸性,则c(H+)>c(OH-),根据溶液中的溶质确定c(NH4+)、c(H+)相对大小;
B.物质的量浓度相等的这几种溶液,NaOH溶液碱性最强,弱酸根离子水解程度越大,溶液的pH越大;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离.
B.物质的量浓度相等的这几种溶液,NaOH溶液碱性最强,弱酸根离子水解程度越大,溶液的pH越大;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离.
解答:
解:A.溶液呈酸性,则c(H+)>c(OH-),如果溶液中的溶质为氯化铵和HCl,且盐酸浓度大于氯化铵,则溶液中c(NH4+)<c(H+),故A错误;
B.物质的量浓度相等的这几种溶液,NaOH溶液碱性最强,弱酸根离子水解程度越大,溶液的pH越大,酸根离子生成程度CH32->CH3COO-,硝酸根离子不水解,所以物质的量浓度相等的这几种溶液,pH大小顺序是:④>③>①>②,故B正确;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故C错误;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,所以氨水抑制水电离、醋酸钠促进水电离,由水电离出的c(OH-)之比=
mol/L:10-10mol/L=106:1,故D错误;
故选B.
B.物质的量浓度相等的这几种溶液,NaOH溶液碱性最强,弱酸根离子水解程度越大,溶液的pH越大,酸根离子生成程度CH32->CH3COO-,硝酸根离子不水解,所以物质的量浓度相等的这几种溶液,pH大小顺序是:④>③>①>②,故B正确;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故C错误;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,所以氨水抑制水电离、醋酸钠促进水电离,由水电离出的c(OH-)之比=
| 10-14 |
| 10-10 |
故选B.
点评:本题考查离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,结合守恒思想解答,易错选项是D,知道然后计算水电离出的c(OH-),为学习难点.

练习册系列答案
相关题目
下列对有机物结构或性质的描述,错误的是( )
| A、乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O |
| B、光照下2,2-二甲基丙烷与Br2蒸气反应,其一溴取代物只有一种 |
C、某有机物球棍结构模型如右图,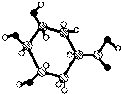 则该有机物能发生消去反应和氧化反应 则该有机物能发生消去反应和氧化反应 |
| D、二十碳五烯酸和二十二碳六烯酸是鱼油的主要成分,它们含有相同的官能团,是同系物,化学性质相似 |
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+.将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.则原混合物中氧化铁的质量是( )
| A、2.4g | B、3.36g |
| C、5.60g | D、6.4g |
分子中碳与氢两元素的质量比为21:4的烃中主链上有5个碳原子的结构共有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
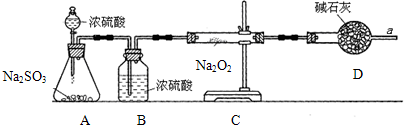
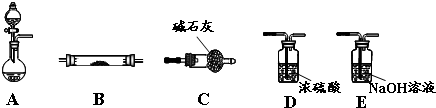
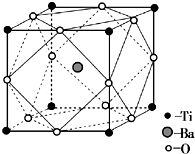 钛被誉为“未来世纪的金属”.试回答下列问题:
钛被誉为“未来世纪的金属”.试回答下列问题: