题目内容
17.将一定体积的某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是( )| A. | 若V1>V2,则说明HA的酸性比HB的酸性强 | |
| B. | 若V1>V2,则说明HA的酸性比HB的酸性弱 | |
| C. | 因为两种酸溶液的pH相等,故V1一定等于V2 | |
| D. | 若将两种酸溶液等体积混合,混合溶液的pH一定等于2 |
分析 pH 均为2的一元酸HA、HB,两种溶液中H+离子浓度相等,酸越弱则酸的浓度越大,与氢氧化钠反应时消耗的体积越小,所以消耗的体积大的酸性较强;若V1>V2,则说明 HA 的酸性比HB的酸性强;若V1=V2,则说明 HA 的酸性与HB的酸性相同.
解答 解:pH 均为2的一元酸HA、HB,两种溶液中H+离子浓度相等,酸越弱则酸的浓度越大,与氢氧化钠反应时消耗的体积越小,所以消耗的体积大的酸性较强;若V1>V2,则说明 HA 的酸性比HB的酸性强;若V1=V2,则说明 HA 的酸性与HB的酸性相同.
A、由以上分析可知,Vl>V2,则说明 HA 的酸性比HB的酸性强,故A正确;
B、由以上分析可知,Vl>V2,则说明 HA 的酸性比HB的酸性强,故B错误;
C、因为不知道两种酸的酸性强弱关系,所以不能判断V1与V2的相对大小,故C错误;
D、若将两种酸溶液等体积混合,如果者是强酸,混合后溶液的pH等于2,弱酸不是,故D错误;
故选A.
点评 本题考查酸性强弱的定性判断,题目难度中等,注意根据两种酸溶液中H+离子浓度相等时,酸越弱则酸的浓度越大这一特点分析判断.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
10.奥运会火炬使用的燃料为丙烷.下列关于丙烷的说法正确的是( )
| A. | 分子中的碳原子在一条直线上 | B. | 可生成三种沸点不同的一氯代物 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 结构简式为CH3CH2CH3 |
8.下列各项操作中,产生“先沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2②向Fe(OH)3胶体中逐滴加入过量的稀硫酸 ③向澄清石灰水溶液中通入过量的CO2④向AlCl3溶液中逐滴加入过量的氢氧化钠溶液.
①向饱和碳酸钠溶液中通入过量的CO2②向Fe(OH)3胶体中逐滴加入过量的稀硫酸 ③向澄清石灰水溶液中通入过量的CO2④向AlCl3溶液中逐滴加入过量的氢氧化钠溶液.
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
5.下列关于胶体叙述正确的是( )
| A. | 胶体和溶液的本质区别是胶体可以发生丁达尔现象 | |
| B. | 0.1molFeCl3溶于水中形成胶体后含有胶体粒子的数目为0.1NA | |
| C. | 明矾净水与胶体的性质有关 | |
| D. | 可以用滤纸分离提纯胶体和溶液 |
12.下列说说法中,正确的是( )
| A. | 非金属性最强的元素,其最高价氧化物对应水化物的酸性最强 | |
| B. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 | |
| C. | 同一主族元素的氢化物,相对分子质贤越大,它的沸点一定越高 | |
| D. | 在周期表中,主族序数都等于该族元素的最外层电子数 |
9.下列表示物质结构的化学用语正确的是( )
| A. | 苯分子的比例模型: | B. | HF的电子式:H:F | ||
| C. | Cl-离子的结构示意图: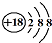 | D. | NH4Cl的电子式: |
6.在实验室中进行分液操作,下列仪器中一定需要的是( )
| A. | 锥形瓶 | B. | 分液漏斗 | C. | 烧杯 | D. | 温度计 |
6.设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 常温下,1 L pH=1的硫酸溶液中含有的H+为0.1NA | |
| B. | 常温下,14g C2H4和C3H6的混合气体中含有2NA个氢原子 | |
| C. | 2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA | |
| D. | 在含有4molSi-O键的石英晶体中,氧原子的数目为4 NA |