题目内容
12.下列说说法中,正确的是( )| A. | 非金属性最强的元素,其最高价氧化物对应水化物的酸性最强 | |
| B. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 | |
| C. | 同一主族元素的氢化物,相对分子质贤越大,它的沸点一定越高 | |
| D. | 在周期表中,主族序数都等于该族元素的最外层电子数 |
分析 A、根据非金属性最强的元素是F,但F没有最高价氧化物对应水化物;
B.碱金属中原子半径越大,熔点越低,而卤素单质中原子半径越大,熔点越高;
C.同一主族的元素对应氢化物中含有氢键时,沸点最高;
D、主族元素最外层电子数等于族序数.
解答 解:A、因非金属性最强的元素是F没有最高价氧化物对应水化物,故A错误;
B.碱金属中原子半径越大,熔点越低,而卤素单质中原子半径越大,熔点越高,则同一主族的元素,原子半径越大其单质的熔点不一定高,故B错误;
C.同一主族的元素对应氢化物中含有氢键时,虽然相对分子质量最小,但沸点最高,故C错误;
D、主族元素最外层电子数等于族序数,所以在周期表中,主族序数都等于该族元素的最外层电子数,故D正确;
故选D.
点评 本题考查元素周期律的递变规律,题目难度不大,注意把握非金属性与非金属的比较,特别是氢键的特点,不能忽视.

练习册系列答案
相关题目
5.配制NaOH溶液时,下列操作情况会使结果偏高的是( )
| A. | 没有洗涤烧杯和玻璃棒 | |
| B. | 使用容量瓶之前发现其内有少量蒸馏水残留 | |
| C. | 定容时,俯视容量瓶刻度线观察液面 | |
| D. | 定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容 |
20.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| B. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个O原子 | |
| C. | 常温常压下,8g CH4的体积为11.2L | |
| D. | 标准状况下,22.4L的H2和CO2混合气体中含有的分子总数为NA |
7.常温下,柠檬水溶液的pH是3,其中的c(OH-)是( )
| A. | 10-11mol/L | B. | 10-3mol/L | C. | 10-7mol/L | D. | 0.1 mol/L |
17.将一定体积的某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是( )
| A. | 若V1>V2,则说明HA的酸性比HB的酸性强 | |
| B. | 若V1>V2,则说明HA的酸性比HB的酸性弱 | |
| C. | 因为两种酸溶液的pH相等,故V1一定等于V2 | |
| D. | 若将两种酸溶液等体积混合,混合溶液的pH一定等于2 |
4.目前工业生产H2O2的一种新方法的生产过程中,会生成一种中间产物,其结构简式为: .有关该物质的说法正确的是( )
.有关该物质的说法正确的是( )
 .有关该物质的说法正确的是( )
.有关该物质的说法正确的是( )| A. | 它属于芳香烃 | B. | 它是苯的同系物的含氧衍生物 | ||
| C. | 它可发生消去反应 | D. | 它可与NaOH溶液反应 |
1.已知在一般的氧化还原反应中,氧化性关系为:氧化剂>氧化产物,还原性:还原剂>还原产物,R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z.这四种离子被还原成0价时表现的氧化性大小符合( )
| A. | R2+>X2+>Z2+>Y2+ | B. | X2+>R2+>Y2+>Z2+ | C. | Y2+>Z2+>R2+>X2+ | D. | Z2+>X2+>R2+>Y2+ |

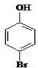 .
. 是化合物 B 的一种同分异构体,用1H 核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境.
是化合物 B 的一种同分异构体,用1H 核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境. .
. .
. .
.