题目内容
9.下列表示物质结构的化学用语正确的是( )| A. | 苯分子的比例模型: | B. | HF的电子式:H:F | ||
| C. | Cl-离子的结构示意图: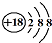 | D. | NH4Cl的电子式: |
分析 A、苯分子为平面结构,C的原子半径大于H原子;
B、氟化氢是共价化合物;
C、氯离子的核内有17个电子;
D、氯化铵由铵根离子和氯离子构成.
解答 解:A、碳原子的相对体积大于氢原子,则苯分子的比例模型为: ,故A正确;
,故A正确;
B、HF为共价化合物,H原子和F原子间以共价键结合,故电子式为 ,故B错误;
,故B错误;
C、氯离子的核内有17个电子,故结构示意图为 ,故C错误;
,故C错误;
D、氯化铵由铵根离子和氯离子构成,是离子化合物,故电子式为: ,故D错误.
,故D错误.
故选A.
点评 本题考查常用化学用语,准确判断物质所含化学键类型、熟练掌握电子式书写方法即可解答,题目难度不大.

练习册系列答案
相关题目
20.下列离子方程式中正确的是( )
| A. | 碳酸钙和盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 过量的氯化铁和锌反应,锌溶解:2Fe3++Zn═2Fe2++Zn2+ | |
| C. | 醋酸和苯酚钠溶液的反应: O-+CH3COOH→ O-+CH3COOH→ OH↓+CH3COO- OH↓+CH3COO- | |
| D. | 碳酸氢钠溶液与氯化铝溶液反应:Al3++3HCO3-═Al(HCO3)3↓ |
20.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| B. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个O原子 | |
| C. | 常温常压下,8g CH4的体积为11.2L | |
| D. | 标准状况下,22.4L的H2和CO2混合气体中含有的分子总数为NA |
17.将一定体积的某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是( )
| A. | 若V1>V2,则说明HA的酸性比HB的酸性强 | |
| B. | 若V1>V2,则说明HA的酸性比HB的酸性弱 | |
| C. | 因为两种酸溶液的pH相等,故V1一定等于V2 | |
| D. | 若将两种酸溶液等体积混合,混合溶液的pH一定等于2 |
4.目前工业生产H2O2的一种新方法的生产过程中,会生成一种中间产物,其结构简式为: .有关该物质的说法正确的是( )
.有关该物质的说法正确的是( )
 .有关该物质的说法正确的是( )
.有关该物质的说法正确的是( )| A. | 它属于芳香烃 | B. | 它是苯的同系物的含氧衍生物 | ||
| C. | 它可发生消去反应 | D. | 它可与NaOH溶液反应 |
14.某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如图所示,对图中曲线的描述正确的是( )
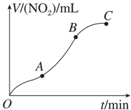

| A. | OA段表示开始时,反应速率稍慢 | |
| B. | AB段表示反应速率较快,一定因为产物有催化作用 | |
| C. | BC段表示随时间增加,反应速率逐渐增大 | |
| D. | BC段表示反应速率最快,在该时间段内收集到的气体最多 |
1.已知在一般的氧化还原反应中,氧化性关系为:氧化剂>氧化产物,还原性:还原剂>还原产物,R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z.这四种离子被还原成0价时表现的氧化性大小符合( )
| A. | R2+>X2+>Z2+>Y2+ | B. | X2+>R2+>Y2+>Z2+ | C. | Y2+>Z2+>R2+>X2+ | D. | Z2+>X2+>R2+>Y2+ |
18.下列关于糖类、脂肪和蛋白质的叙述正确的是( )
| A. | 蛋白质溶液遇CuSO4后产生的沉淀能重新溶解 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 植物油不能使溴的四氯化碳溶液褪色 |
18.下列关于Na2O2的说法正确的是( )
| A. | Na2O2中阴阳离子的个数比为1:1 | |
| B. | Na2O2投入到酚酞溶液中,溶液变红 | |
| C. | Na2O2投与FeCl2溶液的反应:能将Fe2+氧化成Fe3+,得到Fe(OH)3沉淀 | |
| D. | Na2O2与水反应,Na2O2既是氧化剂,又是还原剂 |