题目内容
为了测定某铜银合金的成分,将30g的合金完全溶解于250mL 8mol/L的硝酸中,完全反应后收集到标况下NO、NO2混合气体6.72L,并测得溶液的c(H+)=4mol/L,假使反应后溶液的体积仍然为250mL,则被还原的硝酸的物质的量是 ;合金中银的质量百分含量是 ;若把收集到的气体与氧气混合恰好完全溶于水,所需标准状况下氧气的体积是 .
考点:有关混合物反应的计算
专题:计算题
分析:被被还原的硝酸生成NO、NO2,根据N元素守恒计算被还原的硝酸物质的量;
由题意可知,反应后硝酸有剩余,由氮元素守恒,n(HNO3)=n(气体)+n剩余(HNO3)+2n[Cu(NO3)2]+n(AgNO3),再结合金属质量之和列方程计算n(Cu)、n(Ag),进而计算Ag的质量分数;
若把收集到的气体与氧气混合恰好完全溶于水,又生成硝酸,纵观整个过程,金属失去电子物质的量等于氧气获得电子物质的量,据此计算氧气的物质的量,进而计算氧气体积.
由题意可知,反应后硝酸有剩余,由氮元素守恒,n(HNO3)=n(气体)+n剩余(HNO3)+2n[Cu(NO3)2]+n(AgNO3),再结合金属质量之和列方程计算n(Cu)、n(Ag),进而计算Ag的质量分数;
若把收集到的气体与氧气混合恰好完全溶于水,又生成硝酸,纵观整个过程,金属失去电子物质的量等于氧气获得电子物质的量,据此计算氧气的物质的量,进而计算氧气体积.
解答:
解:①被还原的硝酸生成NO、NO2,根据N元素守恒,被还原的硝酸的物质的量为
=0.3mol;
②由题意可知,反应后硝酸有剩余,由氮元素守恒,n(HNO3)=n(气体)+n剩余(HNO3)+2n[Cu(NO3)2]+n(AgNO3),即n(HNO3)=0.3mol+2n(Cu2+)+n(Ag+)+n(H+),故0.25L×8mol/L=0.3mol+2n(Cu)+n(Ag)+0.25L×4mol/L,则2n(Cu)+n(Ag)=0.7mol,
由金属质量之和,可知64g/mol×n(Cu)+108g/mol×n(Ag)=30g
联立方程,解得:n(Cu)=0.3mol; n(Ag)=0.1mol
合金中银的质量分数=
×100%=36%;
③若把收集到的气体与氧气混合恰好完全溶于水,又生成硝酸,纵观整个过程,金属失去电子物质的量等于氧气获得电子物质的量,所需氧气物质的量为:
=0.175mol,所需标准状况氧气体积是:22.4L/mol×0.175mol=3.92L,
故答案为:0.3mol;36%;3.92L.
| 6.72L |
| 22.4L/mol |
②由题意可知,反应后硝酸有剩余,由氮元素守恒,n(HNO3)=n(气体)+n剩余(HNO3)+2n[Cu(NO3)2]+n(AgNO3),即n(HNO3)=0.3mol+2n(Cu2+)+n(Ag+)+n(H+),故0.25L×8mol/L=0.3mol+2n(Cu)+n(Ag)+0.25L×4mol/L,则2n(Cu)+n(Ag)=0.7mol,
由金属质量之和,可知64g/mol×n(Cu)+108g/mol×n(Ag)=30g
联立方程,解得:n(Cu)=0.3mol; n(Ag)=0.1mol
合金中银的质量分数=
| 0.1mol×108g/mol |
| 30g |
③若把收集到的气体与氧气混合恰好完全溶于水,又生成硝酸,纵观整个过程,金属失去电子物质的量等于氧气获得电子物质的量,所需氧气物质的量为:
| 0.3mol×2+0.1mol×1 |
| 4 |
故答案为:0.3mol;36%;3.92L.
点评:本题考查混合物计算,难度中等,侧重考查学生分析解决问题的能力,关键是利用守恒法进行解得.

练习册系列答案
相关题目
甲、乙两容器都发生反应 2A(g)+B(g)?xC(g),两容器温度和初始压强都相同.甲容器中充入 2molA 和 1molB,达平衡后,C在平衡混合气中的体积分数为φ、物质的量为 n1;乙容器中充入 1.4molA,0.7molB 和 0.6molC,达平衡后C在平衡混合气中的体积分数为φ、物质的量为n2.下列说法中正确的是( )
| A、若甲、乙两容器均为恒容容器,则x必等于2 |
| B、若甲、乙两容器均为恒压容器,则x必等于3 |
| C、若甲为恒容容器、乙为恒压容器,且 x=3,则 n1必大于n2 |
| D、若甲为恒压容器、乙为恒容容器,且 x≠3,则 n1必大于n2 |
恒温恒压下,在容积可变的密闭容器中发生反应:A(g)+B(g)?C(g).若开始时通入1molA和1mol B,达到平衡后生成a mol C,则下列说法错误的是( )
| A、若开始通入3mol A和3mol B,达到平衡后将生成3a mol C | ||
| B、若开始通入3mol A、2mol B和1mol C,达到平衡后密闭容器中C的物质的量可能为3mol | ||
| C、若开始时通入2mol A、2mol B和1mol C,达到平衡时,B的物质的量一定小于2mol | ||
D、若开始时通入2molA、2mol B和1mol C,达到平衡后,再通入2 mol C,则再次到达平衡后,C的物质的量分数为
|
下列说法不正确的是( )
| A、检验SO42-的试剂是HCl和BaCl2 |
| B、检验Cl-的试剂是AgNO3和HNO3 |
| C、向溶液中加入BaCl2后生成白色沉淀,即证明有SO42- |
| D、检验CO32-的试剂HCl,澄清的石灰水,和CaCl2 |
有两种饱和一元醇组成的混合物1.82g 与足量的金属钠作用,生成448mL H2(标准状况下),该混合物可能是( )
| A、CH3OH和CH3CH2CH2OH |
| B、CH3CH2OH和CH3CH(OH)CH3 |
| C、CH3CH2OH和CH3(CH2)3CH2OH |
| D、CH3CH2CH2OH和CH3(CH2)3CH2OH |
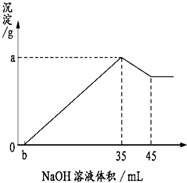 准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,
准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,向滤液中加入10mol/L NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,求所用硫酸溶液的物质的量浓度( )
| A、1.75 mol/L |
| B、3.5 mol/L |
| C、2.25 mol/L |
| D、无法计算 |
10mL 1mol?L-1盐酸与一小块大理石的化学反应:CaCO3+2HCl═CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
| A、加入一定量的CaCl2 |
| B、加入5 mL 1.5 mol?L-1盐酸 |
| C、加入15 mL 0.5 mol?L-1盐酸 |
| D、加入5 mL H2O |