题目内容
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.

试回答下列问题:
(1)请写出元素O的基态原子电子排布式 .
(2)第三周期8种元素按单质熔点高低的顺序如图1,其中序号“8”代表(填元素符号);其中电负性最大的是
(填右图中的序号) .
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是 (填化学式)
(4)i单质晶体中原子的堆积方式如图2甲所示,其晶胞特征如图2乙所示,原子之间相互位置关系的平面图如图2丙所示.
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为 ,一个晶胞中i原子的数目为 ;
②该晶体的密度为 (用字母表示).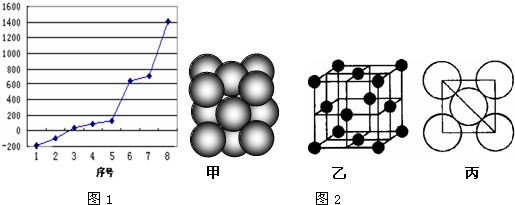

试回答下列问题:
(1)请写出元素O的基态原子电子排布式
(2)第三周期8种元素按单质熔点高低的顺序如图1,其中序号“8”代表(填元素符号);其中电负性最大的是
(填右图中的序号)
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
(4)i单质晶体中原子的堆积方式如图2甲所示,其晶胞特征如图2乙所示,原子之间相互位置关系的平面图如图2丙所示.
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为
②该晶体的密度为

考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)由元素在周期表中的位置可知,元素o处于第四周期第Ⅷ族,元素周期表中第26号元素,为Fe元素,根据核外电子排布规律书写;
(2)由图可知,序号“8”代表的物质熔点最高,第三周期中有原子晶体Si,熔点最高,同周期自左而右电负性增强,第三周期中Cl元素的电负性最大,氯气常温下为气体,比氩气的相对分子质量大,熔点仅高于氩气;
(3)由元素在周期表中的位置可知,j是Si元素,c是C元素,二者形成难熔的晶体为SiC,为原子晶体,利用共价键来分析熔点高低;
(4)①由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用;根据均摊法计算晶胞中含有原子数目;
②由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为,
×4dcm=2
d cm,晶胞体积为(2
dcm)3=16
d3cm3,根据晶胞含有原子数目计算晶胞的质量,再根据ρ=
计算密度.
(2)由图可知,序号“8”代表的物质熔点最高,第三周期中有原子晶体Si,熔点最高,同周期自左而右电负性增强,第三周期中Cl元素的电负性最大,氯气常温下为气体,比氩气的相对分子质量大,熔点仅高于氩气;
(3)由元素在周期表中的位置可知,j是Si元素,c是C元素,二者形成难熔的晶体为SiC,为原子晶体,利用共价键来分析熔点高低;
(4)①由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用;根据均摊法计算晶胞中含有原子数目;
②由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为,
| ||
| 2 |
| 2 |
| 2 |
| 2 |
| m |
| V |
解答:
解:(1)由元素在周期表中的位置可知,元素o处于第四周期第Ⅷ族,为26号元素Fe,原子核外有26个电子,根据构造原理其核外电子排布式为:1s22s22p63s23p63d64s2,
故答案为:1s22s22p63s23p63d64s2;
(2)由图可知,序号“8”代表的物质熔点最高,第三周期中有原子晶体Si,熔点最高,同周期自左而右电负性增强,第三周期中Cl元素的电负性最大,氯气常温下为气体,比氩气的相对分子质量大,熔点仅高于氩气,故2代表氯元素,
故答案为:Si;2;
(3)c是C元素,j是Si元素,二者形成难熔的晶体为SiC,为原子晶体,因Si-Si键的键长大于Si-C键的键长,则SiC中键能大,熔点高,
故答案为:SiC;
(4)①由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用,故配位数为12;晶胞中含有原子数目=8×
+6×
=4,
故答案为:12;4;
②由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为:
×4dcm=2
d cm,晶胞体积为(2
dcm)3=16
d3cm3,晶胞中含有原子数目=8×
+6×
=4,
相对原子质量为M,故晶胞的质量=4×
g,故晶体的密度=
g/cm3=
g/cm3,
故答案为:
g/cm3.
故答案为:1s22s22p63s23p63d64s2;
(2)由图可知,序号“8”代表的物质熔点最高,第三周期中有原子晶体Si,熔点最高,同周期自左而右电负性增强,第三周期中Cl元素的电负性最大,氯气常温下为气体,比氩气的相对分子质量大,熔点仅高于氩气,故2代表氯元素,
故答案为:Si;2;
(3)c是C元素,j是Si元素,二者形成难熔的晶体为SiC,为原子晶体,因Si-Si键的键长大于Si-C键的键长,则SiC中键能大,熔点高,
故答案为:SiC;
(4)①由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用,故配位数为12;晶胞中含有原子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:12;4;
②由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为:
| ||
| 2 |
| 2 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
相对原子质量为M,故晶胞的质量=4×
| M |
| NA |
| ||
16
|
| M | ||
4
|
故答案为:
| M | ||
4
|
点评:本题考查物质结构与性质、元素周期律、核外电子排布、晶胞结构与计算等,注意对电离能突变的理解,晶胞计算需要学生具有一定的数学计算能力与空间想象力,难度中等.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
下列叙述正确的是( )
| A、使C2H5Br和NaOH溶液混合后水解,取上层清液,滴加AgNO3溶液检验溴元素 |
| B、将混有乙烯的乙烷气体通入酸性高锰酸钾溶液,可得到纯净的乙烷气体 |
| C、将苯与溴水混合后,再加铁粉,即可制得溴苯 |
| D、在蔗糖溶液中加入几滴稀硫酸,水浴加热5 min,加入NaOH溶液至碱性,再加入银氨溶液并水浴加热 |
两种气态烃以任意比例混合,在105℃时1L该混合烃与3L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是4L.下列各组混合烃中符合此条件的是( )
| A、CH4、C2H4 |
| B、CH4、C3H6 |
| C、C2H4、C3H8 |
| D、C2H2、C3H6 |
A、B两种有机物无论以何种比例混合,只要混合物的总质量不变,完全燃烧时生成CO2的量也不变,则对于A与B的关系,下列描述正确的是( )
①A、B一定互为同分异构体②A、B一定互为同系物③A、B一定具有相同的最简式④A、B含碳质量分数相同.
①A、B一定互为同分异构体②A、B一定互为同系物③A、B一定具有相同的最简式④A、B含碳质量分数相同.
| A、①②③④ | B、③④ | C、②③ | D、④ |
镁、铝、铁合金投入到300ml硝酸溶液中,金属恰好溶解,转化成Mg2+、Al3+和Fe3+;硝酸全部被还原为NO,且在标准状况下,体积为6.72L,当加入300ml某浓度NaOH,金属阳离子恰好全部沉淀,干燥后测得质量为27.2g.下列有关推断正确的是( )
| A、参加反应HNO3物质的量为0.9mol |
| B、参加反应的金属质量为11.9g |
| C、HNO3物质的量浓度为3mol/L |
| D、NaOH物质的量浓度为6mol/L |
下列有关环境污染的说法正确的是( )
| A、燃煤时加入适量石灰石,可减少废气SO2的排放量 |
| B、空气中臭氧的含量越高,对人体健康越有利 |
| C、PH在5.6-7之间的降水通常称为酸雨 |
| D、含磷洗涤剂易于被细菌分解,故不会导致水体污染 |
下列有关说法正确的是( )
| A、CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 |
| D、铁管上镶嵌锌块,铁管不易被腐蚀 |
 某实验兴趣小组利用如图装置进行电解饱和食盐水并检验其生成产物的实验,当图中开关K闭合片刻后,试填空:
某实验兴趣小组利用如图装置进行电解饱和食盐水并检验其生成产物的实验,当图中开关K闭合片刻后,试填空: