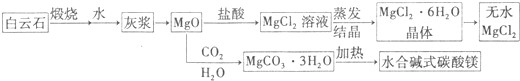
题目内容
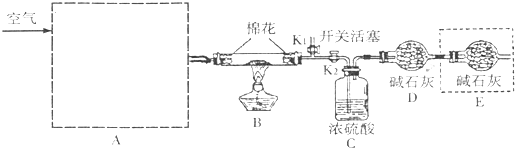
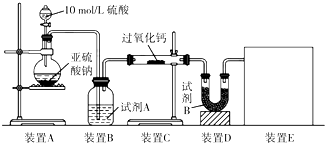 过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、油脂漂白及鱼池增氧等.已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成.有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作,通过测量气体的体积判断发生的化学反应,实验装置如图:
过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、油脂漂白及鱼池增氧等.已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成.有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作,通过测量气体的体积判断发生的化学反应,实验装置如图:(1)试剂A可以选用
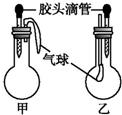
(2)装置 E 用于测定氧气的体积,请在方框中画出装置图.
(3)若实验中产生的SO2足量,且与过氧化钙充分反应,取反应后的固体进行实验探究,以验证过氧化钙与SO2反应的生成物.
提出假设:
假设1:反应后固体只有
假设2:反应后固体中只有
假设3:
(4)实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,装置E 中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、部分被氧化、完全被氧化的 V-m1 关系式.
未被氧化:
考点:性质实验方案的设计
专题:实验设计题
分析:(1)过氧化钙和水反应,装置B中试剂能吸收水蒸气,所以试剂A为浓硫酸;装置E为排水法测定气体体积,则装置D需要除去未反应的二氧化硫,据此判断试剂B的作用;
(2)根据测定氧气的体积利用排水量气法常用装置进行解答;
(3)若反应后固体只有Na2SO3,证明SO2未被氧化;如果反应后固体中只有Na2SO4,证明SO2完全被氧化;如果固体为Na2SO3和Na2SO4的混合物,证明二氧化硫部分被氧化,据此进行解答;
(4)若SO2未被氧化,发生反应为:2CaO2+2SO2=2CaSO3+O2,若二氧化硫全部被氧化发生的反应为:CaO2+SO2=CaSO4,反应过程中无氧气生成,V=0,利用差量法计算出SO2未被氧化、部分被氧化、完全被氧化的 V-m1关系式.
(2)根据测定氧气的体积利用排水量气法常用装置进行解答;
(3)若反应后固体只有Na2SO3,证明SO2未被氧化;如果反应后固体中只有Na2SO4,证明SO2完全被氧化;如果固体为Na2SO3和Na2SO4的混合物,证明二氧化硫部分被氧化,据此进行解答;
(4)若SO2未被氧化,发生反应为:2CaO2+2SO2=2CaSO3+O2,若二氧化硫全部被氧化发生的反应为:CaO2+SO2=CaSO4,反应过程中无氧气生成,V=0,利用差量法计算出SO2未被氧化、部分被氧化、完全被氧化的 V-m1关系式.
解答:
解:(1)过氧化钙(CaO2)和水反应,装置A中试剂需要收水蒸气,所以试剂A为浓硫酸,用于干燥气体除去水蒸气;
装置E为测定生成气体的体积,需要把剩余的二氧化硫除去,所以试剂B的作用是吸收未反应的SO2,
故答案为:浓硫酸;吸收未反应的SO2;
(2)装置E的作用是测定氧气的体积,利用的是排水量气法,可以采用以下几种装置中的一种: ,
,
故答案为: ;
;
(3)反应后的固体可能为Na2SO3或Na2SO4或二者的混合物,所以提出的假设有三种:
假设1:反应后固体只有Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设3:反应后固体为Na2SO3和Na2SO4的混合物,证明SO2部分被氧化;
如果二氧化硫完全被氧化,则反应产物为硫酸钙,二氧化硫全部被氧化,反应的化学方程式为:CaO2+SO2=CaSO4,
故答案为:反应后固体只有Na2SO3;反应后固体中只有Na2SO4;反应后固体为Na2SO3和Na2SO4的混合物,证明SO2部分被氧化;CaO2+SO2=CaSO4;
(4)若SO2未被氧化,发生反应方程式为:2CaO2+2SO2=2CaSO3+O2,依据化学方程式和反应增重计算E中收集的氧气:
2CaO2+2SO2=2CaSO3+O2 固体增重
1mol 96g
mol m1g
1mol×m1g=96g×
mol,
解得:V=
,
若二氧化硫全部被氧化发生的反应为:CaO2+SO2=CaSO4,反应过程中无氧气生成,V=0,
若二氧化硫部分被氧化,则生成的氧气体积范围为:0<V<
,
故答案为:V=
;0<V<
;0.
装置E为测定生成气体的体积,需要把剩余的二氧化硫除去,所以试剂B的作用是吸收未反应的SO2,
故答案为:浓硫酸;吸收未反应的SO2;
(2)装置E的作用是测定氧气的体积,利用的是排水量气法,可以采用以下几种装置中的一种:
 ,
,故答案为:
 ;
;(3)反应后的固体可能为Na2SO3或Na2SO4或二者的混合物,所以提出的假设有三种:
假设1:反应后固体只有Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设3:反应后固体为Na2SO3和Na2SO4的混合物,证明SO2部分被氧化;
如果二氧化硫完全被氧化,则反应产物为硫酸钙,二氧化硫全部被氧化,反应的化学方程式为:CaO2+SO2=CaSO4,
故答案为:反应后固体只有Na2SO3;反应后固体中只有Na2SO4;反应后固体为Na2SO3和Na2SO4的混合物,证明SO2部分被氧化;CaO2+SO2=CaSO4;
(4)若SO2未被氧化,发生反应方程式为:2CaO2+2SO2=2CaSO3+O2,依据化学方程式和反应增重计算E中收集的氧气:
2CaO2+2SO2=2CaSO3+O2 固体增重
1mol 96g
| V |
| 22.4 |
1mol×m1g=96g×
| V |
| 22.4 |
解得:V=
| 7m1 |
| 30 |
若二氧化硫全部被氧化发生的反应为:CaO2+SO2=CaSO4,反应过程中无氧气生成,V=0,
若二氧化硫部分被氧化,则生成的氧气体积范围为:0<V<
| V |
| 22.4 |
故答案为:V=
| 7m1 |
| 30 |
| V |
| 22.4 |
点评:本题考查了性质实验方案的设计方法及有关范围讨论化学计算,题目难度中等,明确题干信息及实验目的为解答此类题的关键,解答过程中实验设计的步骤和实验方案的确定需要根据题干要求分析,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
下列有关实验操作的说法正确的是( )
| A、用10mL量筒量取8.10mL稀盐酸 |
| B、用pH计测得某溶液的pH为2.2 |
| C、用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 |
| D、可用25mL酸式滴定管量取20.00mL KMnO4溶液 |
设NA为阿伏伽德罗常数的数值,下列叙述正确的是( )
| A、已知N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,在该反应中,当有3NA电子转移时,上述热化学反应方程式的焓变变为△H=46.2kJ/mol |
| B、1 L 0.1mol?L-1碳酸钠溶液的阴离子总数等于0.1 NA |
| C、室温下pH=13的NaOH溶液中含有的OH-0.1 NA |
| D、浓度分别为1 mol?L-1和 0.5mol?L-1的CH3COOH和CH3COONa 混合液共1L,含CH3COOH 和 CH3COO-共1.5 mol |
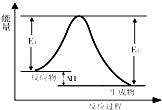 关于反应3A (g)+B (g)?2C (g) 发生过程中的能量变化如图,下列说法中不正确的是( )
关于反应3A (g)+B (g)?2C (g) 发生过程中的能量变化如图,下列说法中不正确的是( )| A、该反应为放热反应 |
| B、反应体系中加入催化剂,E1、E2减小,△H不变 |
| C、增大反应体系压强,化学平衡正向移动,气体B的浓度减少 |
| D、降低反应体系温度,反应速率减慢,A的转化率增大 |
某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断不正确的是( )
| A、肯定不含I- |
| B、肯定不含Cu2+ |
| C、肯定含有SO32- |
| D、可能含有I- |
氢氧化镁固体在水中溶解,有下列平衡:Mg(OH)2(s)?Mg2++2OH-,加入下列哪种固体物质可使Mg(OH)2固体的质量减少( )
| A、Na2CO3 |
| B、MgCl2 |
| C、NH4Cl |
| D、NaCl |