题目内容
11.配制500mL 18mol/L的氢氧化钠溶液需要氢氧化钠多少克?分析 根据n=cV计算物质的量,结合m=nM计算.
解答 解:n(NaOH)=0.5L×18mol/L=9mol,m(NaOH)=9mol×40g/mol=360g,
答:配制500mL 18mol/L的氢氧化钠溶液需要氢氧化钠360g.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、体积的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.图中,表示正反应是吸热反应的是( )
| A. |  | B. |  | C. |  | D. |  |
2.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 铝和盐酸反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 氢气还原氧化铜 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
19.下列实验操作能达到相应实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化 | 证明二氧化硫具有漂白性 |
| B | 验证电离H+的能力HClO>HCO3- | 向 NaHCO3溶液中加入新制氯水,观察溶液中是否有气泡冒出 |
| C | 相同条件下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液 | 探究Cu2+、Fe3+对H2O2分解速率的影响 |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴84消毒液,观察红色褪色的快慢 | 证明随溶液pH的减少,84消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
3.如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定).
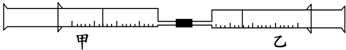
试回答下列问题:
(1)实验1中,沉淀最终变为红褐色色,写出生成白色沉淀的离子方程式:Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+.
(2)实验2中,甲中最后剩余的无色气体是NO,写出NO2与H2O反应的化学方程式3NO2+H2O═2HNO3+NO.
(3)实验3中,已知:3Cl2+2NH3═N2+6HCl.甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为黄绿色变为无色,最后针筒内剩余气体的体积约为5mL.

| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒 的现象 |
| 1 | 10mL FeSO4溶液 | 10mL NH3 | 生成白色沉淀,后变色 |
| 2 | 30mL NO2 | 10mL H2O(l) | 剩无色气体 |
| 3 | 15mL Cl2 | 40mL NH3 |
(1)实验1中,沉淀最终变为红褐色色,写出生成白色沉淀的离子方程式:Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+.
(2)实验2中,甲中最后剩余的无色气体是NO,写出NO2与H2O反应的化学方程式3NO2+H2O═2HNO3+NO.
(3)实验3中,已知:3Cl2+2NH3═N2+6HCl.甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为黄绿色变为无色,最后针筒内剩余气体的体积约为5mL.
20.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 L 0.1mol•L-1的氨水含有0.1NA个OH- | |
| B. | 常温常压下,22.4 LCCl4含有NA个CCl4分子 | |
| C. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 常温下,23g N2O4和NO2的混合气体中,含有NA个氧原子 |
1.常温下,下列各组离子一定能大量共存的是( )
| A. | 滴加石蕊显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | [H+]=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | [OH-]/[H+]=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离的[H+]=1.0×10-13 mol•L-1的溶液中:K+、NH4+、AlO2-、HCO3- |

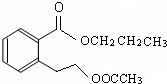 或
或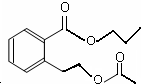 .
.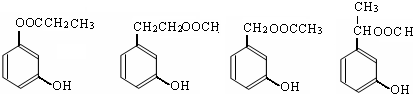 (其中一种).
(其中一种).