题目内容
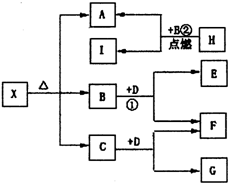 已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.
已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题:
(1)G的化学式为:
(2)写出下列反应的化学方程式
①
②
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量之比为3:8,则X的化学式为:
X与盐酸反应的化学方程式为:
考点:无机物的推断
专题:
分析:H是金属单质,在B中点燃反应生成A、I,I是常见非金属单质,②为燃烧条件下的置换反应,可推断为:H为Mg,I为C,A为MgO,B为CO2;B+D=E+F,F为非金属单质,E为工业上重要的碱性物质,推断为:D为Na2O2,E为Na2CO3,F为O2,G是工业上重要的碱性物质,C+Na2O2=G+O2;可以判断:G为NaOH,C为H2O;上述分析得到,X是-种盐,X分解得到MgO、CO2、H2O;推断X为镁的碳酸盐,结合判断出的物质分析回答问题.
解答:
解:H是金属单质,在B中点燃反应生成A、I,I是常见非金属单质,②为燃烧条件下的置换反应,可推断为:H为Mg,I为C,A为MgO,B为CO2;B+D=E+F,F为非金属单质,E为工业上重要的碱性物质,推断为:D为Na2O2,E为Na2CO3,F为O2,G是工业上重要的碱性物质,C+Na2O2=G+O2;可以判断:G为NaOH,C为H2O;上述分析得到,X是-种盐,X分解得到MgO、CO2、H2O,推断X为镁的碳酸盐,
(1)由以上分析可知G为NaOH,故答案为:NaOH;
(2)反应①为二氧化碳与过氧化钠的反应,反应方程式为2Na2O2+2CO2=2Na2CO3+O2,反应②为镁在二氧化碳中的燃烧,反应的方程式为2Mg+CO2
2MgO+C,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;2Mg+CO2
2MgO+C;
(3)X在医药上用作解酸剂,X为镁的碳酸盐,与盐酸作用时,生成B(CO2)的物质的量与消耗盐酸的物质的量之比为3:8,生成产物氯化镁、二氧化碳和水,依据反应中原子守恒和反应性质可知,1molX中含碳酸根离子为3mol,含镁离子4mol,依据化合价代数和为0和原子守恒得到X的化学式为Mg4(OH)2(CO3)3或Mg(OH)2?3MgCO3,与盐酸反应的化学方程式:Mg4(OH)2(CO3)3+8HCl=4MgCl2+3CO2↑+5H2O,
故答案为:Mg4(OH)2(CO3)3或Mg(OH)2?3MgCO3;Mg4(OH)2(CO3)3+8HCl=4MgCl2+3CO2↑+5H2O.
(1)由以上分析可知G为NaOH,故答案为:NaOH;
(2)反应①为二氧化碳与过氧化钠的反应,反应方程式为2Na2O2+2CO2=2Na2CO3+O2,反应②为镁在二氧化碳中的燃烧,反应的方程式为2Mg+CO2
| ||
故答案为:2Na2O2+2CO2=2Na2CO3+O2;2Mg+CO2
| ||
(3)X在医药上用作解酸剂,X为镁的碳酸盐,与盐酸作用时,生成B(CO2)的物质的量与消耗盐酸的物质的量之比为3:8,生成产物氯化镁、二氧化碳和水,依据反应中原子守恒和反应性质可知,1molX中含碳酸根离子为3mol,含镁离子4mol,依据化合价代数和为0和原子守恒得到X的化学式为Mg4(OH)2(CO3)3或Mg(OH)2?3MgCO3,与盐酸反应的化学方程式:Mg4(OH)2(CO3)3+8HCl=4MgCl2+3CO2↑+5H2O,
故答案为:Mg4(OH)2(CO3)3或Mg(OH)2?3MgCO3;Mg4(OH)2(CO3)3+8HCl=4MgCl2+3CO2↑+5H2O.
点评:本题考查了物质转化关系判断,物质性质的综合应用,主要考查工业重要的两种碱的性质判断,过氧化钠性质应用,关键是二氧化碳和金属镁发生的特征反应的推断.

练习册系列答案
相关题目
下列各组物质中,所含分子数相同的是( )
| A、10g H2和10g O2 |
| B、7g N2和11g CO2 |
| C、9g H2O和0.5mol Br2 |
| D、224mL H2(标准状况)和0.1mol N2 |
 经检验,“毒豆芽”中含有一种动物用药恩诺沙星,其分子结构如图所示,下列有关恩诺沙星的说法不正确的是( )
经检验,“毒豆芽”中含有一种动物用药恩诺沙星,其分子结构如图所示,下列有关恩诺沙星的说法不正确的是( )| A、难溶于水,可溶于烧碱和碳酸钠溶液 |
| B、分子式为C19H21FN3O3 |
| C、该物质能发生酯化、加成、氧化、硝化、水解反应 |
| D、该物质的一氯代物共有9种 |
下列说法正确的是( )
A、按系统命名法, 的名称是2,3-二乙基丁烷 的名称是2,3-二乙基丁烷 |
B、某烃的衍生物A的分子式为C6H12O2,已知 ,又知D不与NaHCO3溶液反应,C和E都不能发生银镜反应,则A的结构可能有4种 ,又知D不与NaHCO3溶液反应,C和E都不能发生银镜反应,则A的结构可能有4种 |
| C、完全燃烧相同碳原子、且相同质量的烷烃、烯烃、炔烃,耗氧量最大的是烷烃 |
| D、已知烃A的分子式为C5Hm,烃B的最简式为C5Hn(m、n均为正整数),则烃A和烃B不可能互为同系物 |
常温下,下列有关HNO3溶液的叙述正确的是( )
| A、该溶液中,K+、Fe2+、SO42-、Br-可以大量共存 |
| B、溶液pH=1时,由水电离出的氢离子浓度为1×10-13 mol/L |
| C、1L 0.1mol/L该溶液和足量的Zn充分反应,生成1.12L H2 |
| D、稀溶液中通SO2反应的离子方程式为:2SO2+H2O+2NO3-=2SO42-+2NO↑+2H+ |
 向10.00mL0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/LNaOH溶液,溶液PH值变化曲线如图所示.下列说法不正确的是( )
向10.00mL0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/LNaOH溶液,溶液PH值变化曲线如图所示.下列说法不正确的是( )| A、HA是弱酸 |
| B、c点时,V=10.00ml |
| C、b点表示的溶液中:2c(Na+)=c(A-)+c(HA) |
| D、b、c、d点表示的溶液中c(Na+)+c(H+)=c(A-)+c(OH-) |